Prädiktive Genetik: Was Gene über Übergewicht, Cholesterin und den metabolischen Zustand aussagen
Die moderne Medizin steht an der Schwelle zu einem Paradigmenwechsel: Weg von der generischen Behandlung hin zu einer individualisierten Herangehensweise, die auf den genetischen Besonderheiten jedes einzelnen Patienten basiert. Die prädikative Genetik, ein Teilbereich der personalisierten Medizin, ermöglicht es, anhand genetischer Marker, wie den sogenannten Single Nucleotide Polymorphisms (SNPs), Vorhersagen über das Risiko für bestimmte Erkrankungen zu treffen sowie Interventionsmaßnahmen aufzudecken, die dieses Risiko minimieren und die allgemeine Gesundheit verbessern können.
Diese Erkenntnisse könnten also genutzt werden, um präzise Therapien und präventive Maßnahmen zu entwickeln, die auf den individuellen genetischen Hintergrund abgestimmt sind. Dies ermöglicht nicht nur eine gezieltere Behandlung, sondern auch die frühzeitige Identifikation von Risikopatienten. Kann der personalisierte Ansatz also regelhaft in den Praxisalltag eingebunden werden, so verspricht das nicht nur potenziell eine Verbesserung des Behandlungserfolgs, sondern auch einen effektiven Ansatz zur Prävention von Risikopatienten – etwas, was viel diskutiert wird, bei der Umsetzung aber leider oft scheitert.
Ein Teilgebiet, welches im Folgenden genauer beleuchtet werden soll, ist die Nutrigenetik. Es soll darauf geblickt werden, wie dieser Teil der prädiktiven Genetik genutzt werden kann, um das Risiko für häufige Krankheitsbilder wie Adipositas und diverse andere Stoffwechselerkrankungen zu evaluieren und personalisierte Behandlungsstrategien zu entwickeln, wobei kein Anspruch auf Vollständigkeit besteht, sondern lediglich exemplarisch auf die große und zunehmende Rolle genetischer Untersuchungen in der Nutrigenetik hingewiesen werden soll. Erfahren Sie, welche genetischen Marker eine Rolle spielen, wie sie in der Praxis angewendet werden können und welche Vorteile dies für Ihre Patienten bietet.
Was ist Nutrigenetik?
Die Nutrigenetik ist ein Teilgebiet der Genetik, welches die Beziehungen zwischen Genen und Ernährung behandelt. Die Nutrigenetik kann im Zusammenhang mit der prädiktiven Genetik auch als Präzisionsvorbeugung oder Präzisionsernährungstherapie verstanden werden, denn die Diversität der genetischen Profile zwischen Individuen spezifischer ethnischer Gruppen beeinflusst Anforderungen an die Ernährung und den Stoffwechsel sowie Auswirkungen auf die Ernährungstherapie (Ferguson et al., 2016). In Zukunft werden Nutrigenetik und Nutrigenomik mit Daten anderer Omics-Technologien wie Epigenomik, Proteomik, Lipidomik, Foodomics, Metabolomik sowie Mikrobiom- und Datentechnologie kombiniert (Singh, 2023).
Es ist allgemein bekannt und durch zahlreiche Veröffentlichungen belegt, dass eine falsche Ernährung zu verschiedenen Erkrankungen beitragen oder diese verursachen kann. Zu diesen Erkrankungen gehören z. B. Adipositas, Diabetes, Herz-Kreislauf-Erkrankungen, Krebs und Entzündungen (Guevara-Ramirez et al., 2022). Im Speziellen kann eine nutrigenetische Testung genbasierte Ernährungsempfehlungen aussprechen und damit dazu beitragen, Krankheiten zu verhindern oder die Gesundheit zu verbessern (Lal et al., 2022). Das Paradigma der Präzisionsernährung basiert auf der Prämisse, dass erhebliche Unterschiede zwischen Menschen hinsichtlich des ernährungsbedingten Krankheitsrisikos und der Reaktion auf diätetische Interventionen bestehen (Mitchelson et al., 2023).
Nutrigenetische Tests betreffen beispielsweise verschiedene Aspekte im Zusammenhang mit Stoffwechselveränderungen, wie hohem Body Mass Index, zentrale Adipositas, Insulinresistenz, aber auch den zwischen Ernährung und Schlaf oder mit der Appetitregulierung und -kontrolle.
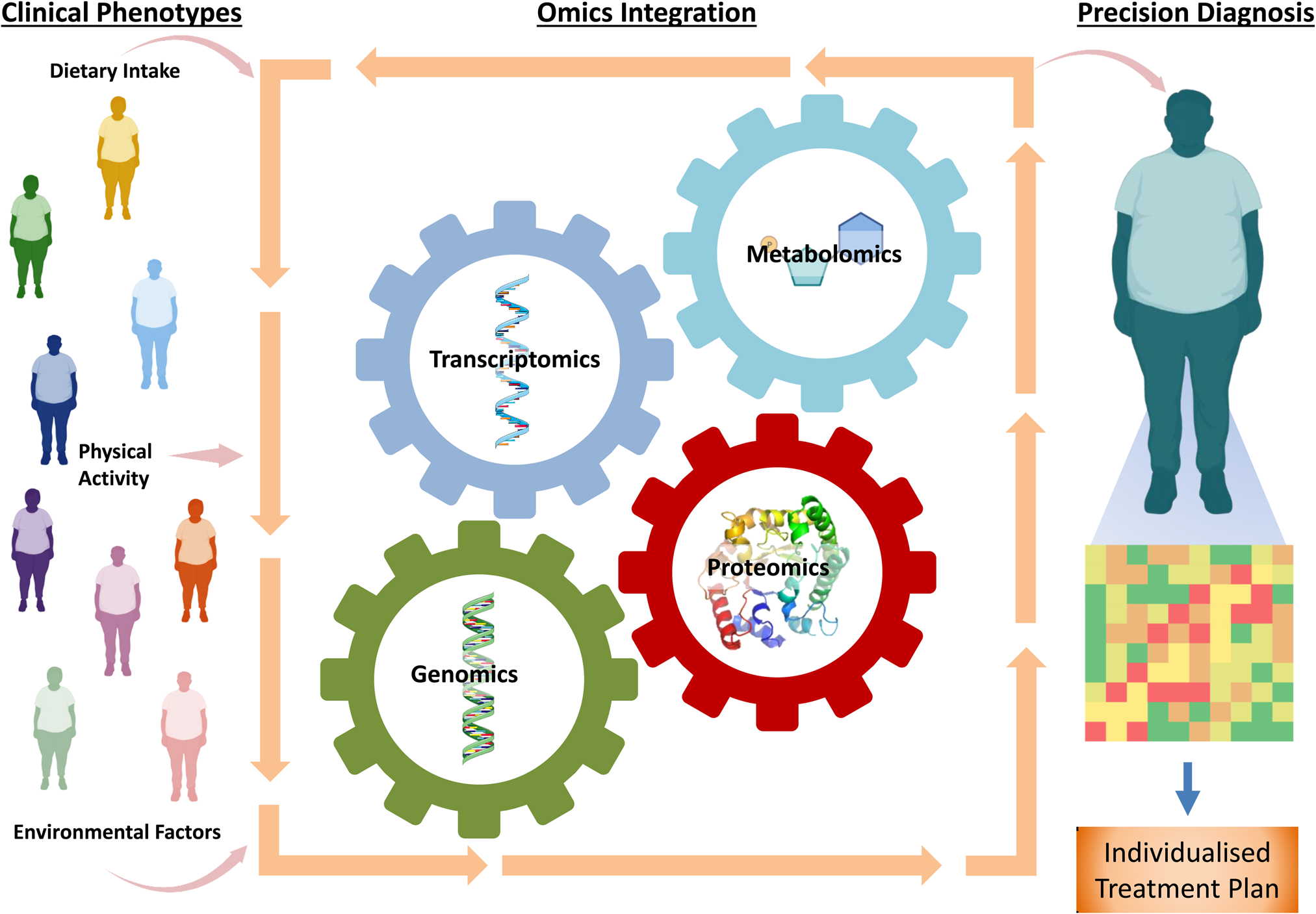
Abbildung 1: Schematische Darstellung des komplexen Ablaufs zur Erstellung personalisierter Behandlungspläne nach dem Prinzip der Präzisionsernährung auf Basis des aktuellen Lifestyles sowie unter Beachtung der genetischen Prädispositionen und weiteren Einflussfaktoren (adaptiert aus Mitchelson et al., 2023)
Weitere Einflüsse der Nutrigenetik lassen sich im Bereich der Nahrungsmittelintoleranzen sowie innerhalb des Stoffwechsels von Vitaminen und Mineralstoffen. Diese werden detailliert auf den Seiten … bis … beleuchtet.
Das FTO-Gen, Adipositas und gängige Polymorphismen
Adipositas ist eine chronische Krankheit, die definiert ist, als eine über das Normalmaß hinausgehende Vermehrung des Körperfetts. Berechnungsgrundlage dafür ist der Body Mass Index (BMI), der einen Quotienten aus Gewicht und Köpergröße zum Quadrat (kg/m2) darstellt. Im Vergleich zum Jahr 1999 stieg die Übergewicht- und Adipositas-Prävalenz in den vergangenen Jahren deutlich an. In Deutschland sind 2022 insgesamt 53,5 % der Bevölkerung (46,6% der Frauen und 60,5% der Männer) von Übergewicht (einschließlich Adipositas) betroffen. Bei 19,0% der Erwachsenen liegt eine Adipositas vor (Schienkiewitz et al., 2022). Es besteht also akuter Handlungs- und Präventionsbedarf, denn die Zahl an mit Übergewicht und Adipositas assoziierten Erkrankungen ist groß.

Abbildung 2: Übergewicht- und Adipositas-Prävalenz der Erwachsenen in Deutschland, Verteilung nach Alter und Geschlecht (adaptiert aus Schienkiewitz et al., 2022)
Durch genomweite Assoziationsstudien wurden zahlreiche mit Adipositas in Zusammenhang stehende Genloci identifiziert. Dabei war das Fettmasse- und Adipositas-assoziierte Gen (FTO-Gen), welches auf dem Chromosom 16q12.2 lokalisiert ist (9 Exons und 8 Introns), eines der ersten und am besten beschriebenen Adipositas-assoziierten Gene (Loos, 2012).
Funktionell ist das Produkt des FTO-Gens ein Enzym mit mRNA-Demethylasefunktion (v. a. N6-(Di-)Methyladenosin-Demethylase; m6A-Demethylase). Zahlreiche zelluläre Prozesse werden durch m6A-Modifikation moduliert, darunter alternatives Spleißen, mRNA-Stabilität, Translation, Transport, Abbau und Genregulation, das Ungleichgewicht von m6A wurde mit daher verschiedenen Erkrankungen in Verbindung gebracht, darunter Fettleibigkeit, Diabetes, Herzversagen, Hirnerkrankungen und verschiedene Tumore (Azzam et al., 2022).
Interessanterweise könnte das FTO-Gen so eine gemeinsame genetische Grundlage für die Zunahme von Fettleibigkeit und Krebs bilden (Lan et al., 2020). Adipositas erhöht das Krebsrisiko bei mindestens 13 Krebsarten (Goodwin & Stambolic, 2015) und steht weiterhin in einem engen Zusammenhang mit einem breiten Spektrum teils pathologischer Verhaltensauffälligkeiten, wie z. B. Aufmerksamkeitsdefiziten, affektiven Symptomen und Drogenmissbrauch (Hess & Bruning, 2014) und auch von Herz-Kreislauf-Erkrankungen (Liu et al., 2013; Xu et al., 2023). Eine Betrachtung des FTO-Gens und der relevanten SNPs in diesem Zusammenhang hat also auch aus dieser Perspektive eine potenzielle Relevanz in der Prävention.
FTO-SNP rs9939609 (T/A)
Der klassische BMI-bezogene FTO-SNPs war rs9939609 (T/A). 16 % der Erwachsenen, die das homozygote Risikoallel (AA) trugen, nahmen fast 3 kg an Gewicht zu und das Risiko für eine Fettleibigkeit stieg um das 1,67-Fache (Frayling et al., 2007). Menschen mit FTO-Risiko-Allelen neigen zu einer energiereicheren Ernährung und einem verringerten Sättigungsgefühl und können die Kontrolle über das Essen verlieren (Ahmad et al., 2011; Cecil et al., 2008; Sonestedt et al., 2009; Tanofsky-Kraff et al., 2009). Genomweite Assoziationsstudien (GWAS) haben Varianten innerhalb von Introns von FTO reproduzierbar mit einem erhöhten Risiko für Fettleibigkeit und Typ-2-Diabetes in Verbindung gebracht (Dina et al., 2007; Frayling et al., 2007; Scuteri et al., 2007).
Dieser SNP wird weiterhin mit einem erhöhten BMI oder erhöhter Energieaufnahme (Speakman et al., 2008) bei Europäern, Brasilianer und Chinesen in Verbindung gebracht (da Fonseca et al., 2019; Jiang et al., 2019; Mehrdad et al., 2020). Bei erwachsenen Menschen konnte gezeigt werden, dass diese mit den gefährdeten AT- und AA-Allelen täglich zwischen 500 und 1250 kJ mehr zu sich nahmen als Träger des schützenden TT-Genotyps (Speakman et al., 2008). Der Genotyp FTO rs9939609 wurde außerdem mit einer erhöhten Expression des Hormons Ghrelin in Verbindung gebracht, welches das Verdauungsverhalten reguliert und zu einer erhöhten Aufnahme von kalorienreicheren Lebensmitteln führt (Karra et al., 2013).
Das menschliche FTO-Gen mit den genetischen Varianten rs9939609 und rs9930506, die beide im Intron 1 sind, trägt zudem erheblich zur frühen Entstehung des metabolischen Syndroms bei Kindern und Jugendlichen bei (Song et al., 2023). Die mit Fettleibigkeit verbundene nicht-kodierende Region innerhalb des FTO-Gens (Introns) interagiert direkt mit dem Promotor von IRX3 und IRX5, die ebenfalls mit Fettleibigkeit in Verbindung stehen (Smemo et al., 2014). Mit Fettleibigkeit assoziierte FTO-SNPs im Intron 1 (wie rs9939609, aber auch rs17817449, rs3751812, rs1421085, rs9930506 und rs7202116) weisen insgesamt eine starke Assoziation mit Übergewicht oder Fettleibigkeit auf.
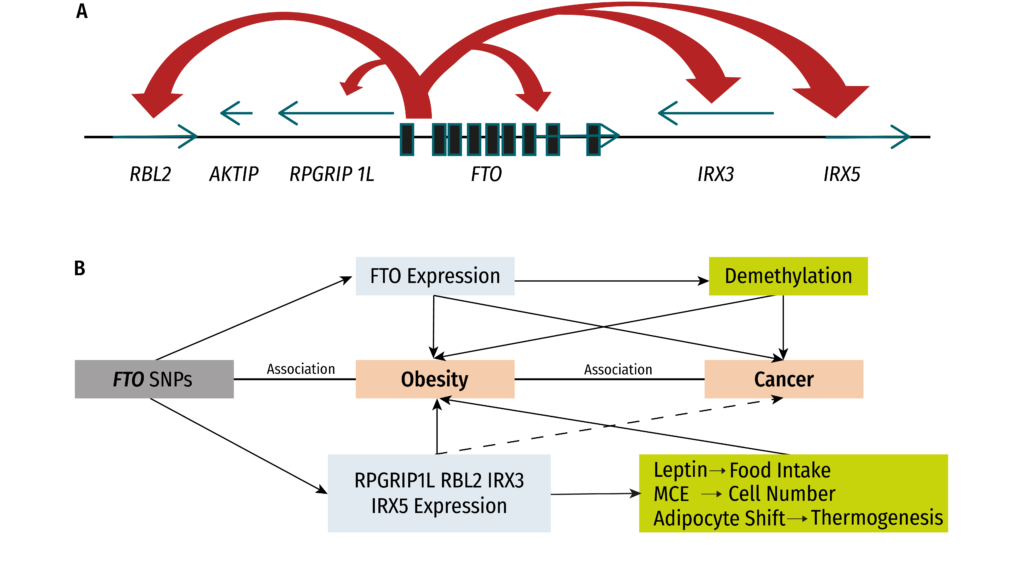
Abbildung 3: Schematische Darstellung des Einflusses verschiedener SNPs im Bereich des Intron 1 des FTO-Gens auf die Expression anderer Gene; diese zusätzliche Regulation ist ein Ansatzpunkt zur Erklärung der Assoziation der FTO-SNPs mit Übergewicht und Krebs (adaptiert aus Lan et al., 2020)
Die Ergebnisse deuten zwar klar auf den Zusammenhang des Risikoallels von rs9939609, das Ausmaß und der Eintritt der Adipositas ist jedoch vermutlich abhängig vom Lebensstil der Individuen. Eine groß angelegte Metaanalyse (218.166 Erwachsene und 19.268 Kinder) zeigte, dass das homozygote FTO-Risikoallel (rs9939609) mit einem um 27 % geringeren Risiko für Fettleibigkeit bei körperlich aktiven Erwachsenen verbunden war, im Vergleich zu jenen, die inaktiv waren und das Risikoallel trugen (Kilpelainen et al., 2011). Diese Ergebnisse wurden kürzlich bestätigt und erneut auf die Notwendigkeit einer erhöhten körperlichen Aktivität bei Personen mit dem Risikophänotyp (rs9939609) hingewiesen (Martinez-Lopez et al., 2024). Epigenetische Einflüsse auf das FTO-Gen werden als neuer Ansatz in der Behandlung der Adipositas abhängig vom Einzelnukleotid-Polymorphismus diskutiert (Popovic et al., 2023).
Nicht nur der klassische Polymorphismus rs9939609 zeigt Assoziationen mit der Entstehung von Übergewicht und Adipositas. Auch andere SNPs, besonders jene, die sich im Intron 1 befinden, zeigen sich als relevant. Daher sollen im Folgenden auch die weiteren SNPs kurz aufgeführt werden.
Weitere FTO-SNPs
Der Polymorphismus rs9930506 ist sowohl bei Europäern und verschiedenen anderen Ethnien (z.B. Asiaten) mit der Gewichtsregulation und einem erhöhten BMI assoziiert (Cauchi et al., 2009; Chang et al., 2008; Dina et al., 2007; Haupt et al., 2008; Scuteri et al., 2007). Auch die SNPs rs1421085, rs8050136 und rs1121980 sind bei Europäern mit einer Adipositas verbunden (Cauchi et al., 2009; Dina et al., 2007; Haupt et al., 2008; Scuteri et al., 2007).
Je nach Abstammung unterscheidet sich der Einfluss eines SNPs auf die Entwicklung von Übergewicht und Adipositas. Der SNP rs17817449 zeigt beispielsweise besonders bei Menschen mit chinesischer Abstammung eine hohe Korrelation mit dem BMI (Wen et al., 2012).
FTO-Gen und weitere Pathologien
Einige Polymophismen des FTO-Gens (rs9939609, rs8050136, rs1477196, rs6499640, rs1121980, rs17817449, rs11075995, rs8047395 und rs7206790) sind mit einem höheren Krebsrisiko verbunden (Hernandez-Caballero & Sierra-Ramirez, 2015).
Der typischste FTO-SNP rs9939609 wurde mit Lungenkrebs, Nierenkrebs, Brustkrebs, Prostatakrebs, Bauchspeicheldrüsenkrebs und Gebärmutterkrebs in Verbindung gebracht (Delahanty et al., 2011; Kaklamani et al., 2011; Lin et al., 2013). Allerdings wurde eine Schutzfunktion des AG-Genotyps (rs9930506) gegen das Bronchialkarzinom postuliert (Hernandez-Caballero et al., 2024).
Jüngste Studien haben zudem gezeigt, dass das FTO-Gen eine entscheidende Rolle bei der Entstehung und dem Fortschreiten von Herz-Kreislauf-Erkrankungen wie Myokardfibrose, Herzinsuffizienz und Arteriosklerose spielt (Xu et al., 2023).
Es bleibt also spannend um die Einflüsse des FTO-Gens, die vermutlich weit über das metabolische Syndrom und Adipositas hinausreichen. Im Kontext der Prävention kann anhand einer Bestimmung eventueller Polymorphismen des FTO-Gens gegebenenfalls eine Optimierung des Lebensstils erfolgen, beispielsweise hinsichtlich der Ernährung und körperlicher Betätigung.
ApoE-Gen: Einfluss von Genpolymorphismen auf den Lipidstoffwechsel
Ein weiteres Gen, das es in diesem Kontext zu erwähnen gilt, ist das ApoE und die entsprechenden Polymorphismen. Das ApoE kodierende Gen ApoE befindet sich auf Chromosom 19q13.2 und enthält vier Exons und drei Introns (Marais, 2019). Apolipoprotein E (ApoE) ist ein ubiquitäres Lipidtransportprotein, das eine Vielzahl von Lipidspezies bindet, darunter Cholesterin, Phospholipide und Triglyceride in Lipoproteinpartikeln (Mahley et al., 2009). Das ApoE ein Protein mit einer zentralen Rolle im Cholesterol- und Lipid-Transport und -Stoffwechsel (Mahley, 1988).
Das Protein ApoE transportiert Triglyzeride, fettlösliche Vitamine und Cholesterin zuerst in die Lymphbahn und dann ins Blut. Das ApoE-Gen existiert in drei Hauptallelen: ApoE2, ApoE3 und ApoE4. Bei 3 Genvarianten ergeben sich, da je eine Kopie von jedem Elternteil weitergegeben wird, 6 Genotypen (Apo E2/E2, Apo E2/E3, Apo E2/E4, Apo E3/E3, Apo E3/E4 und Apo E4/E4). Der häufigste Genotyp ist E3/E3.
Dass ApoE4-Träger ein erhöhtes Risiko haben, am M. Alzheimer zu erkranken, ist bekannt. Diese verschiedenen ApoE-Allele beeinflussen allerdings auch, wie Cholesterin und andere Lipide im Körper verstoffwechselt werden. Dies spielt für das Auftreten von Herz-Kreislauf-Erkrankungen eine entscheidende Rolle, denn Dyslipidämie ist eine der Ursachen für die koronare Herzkrankheiten (KHK) und ApoE-Genpolymorphismen beeinflussen den Lipidspiegel.
Im Vergleich zu ApoE3 ist ApoE4 beispielsweise mit einem erhöhten Risiko für nicht-neurologische Erkrankungen wie Hypercholesterinämie, Hypertriglyzeridämie und Herz-Kreislauf-Erkrankungen verbunden (Bennet et al., 2007; Carvalho-Wells et al., 2012; Dallongeville et al., 1992). Es besteht ein signifikanter Zusammenhang zwischen dem ApoE4-Allel und einer Hypercholesterinämie (Lozano et al., 2021). Die Auswirkungen von ApoE4 Trägern auf das LDL-Cholesterin (höheres Gesamt- und LDL-Cholesterin und niedrigeres HDL-Cholesterin) werden ausführlich bei Dunk et al. 2023 (Dunk et al., 2023) diskutiert.
Ein erhöhtes LDL-Cholesterin ist ein bekannter Risikofaktor für Arteriosklerose, Herz-Kreislauf-Erkrankungen wie Herzkrankheiten und Schlaganfälle (Mahley, 2016; Mahley & Rall, 2000; Mahley et al., 2009). Es konnte gezeigt werden, dass ApoE4 zu einer vorzeitigen KHK führt (Zhao et al., 2017). Allerdings sind die Aussagen nicht einheitlich. Die Ergebnisse einer Metaanalyse legen nahe, dass verschiedene ApoE-Allele in verschiedenen Ethnien zu unterschiedlichen Effekten führen könnten, so ist das ApoE2-Allel bei Asiaten ein Risikofaktor für eine vorzeitige koronare Herzerkrankung, während es bei Kaukasiern einen Schutzfaktor darstellen könnte (Zhao et al., 2017). ApoE2 bindet jedoch fehlerhaft an den LDL-Rezeptor (ca. 2 % der normalen Aktivität), da es an Position 158 einen Cysteinrest statt eines Argininrests wie ApoE3 und ApoE4 aufweist (Mahley, 2016). Wegen fehlerhafter Bindung an LDL-Rezeptoren kann die Homozygotie von ApoE2 eine Hyperlipoproteinämie Typ III auslösen, jedoch nur, wenn eine andere Erkrankung zu einer Überproduktion von VLDL oder zu weniger LDL-Rezeptoren führen (Mahley et al., 1999; Mahley & Rall, 2000).
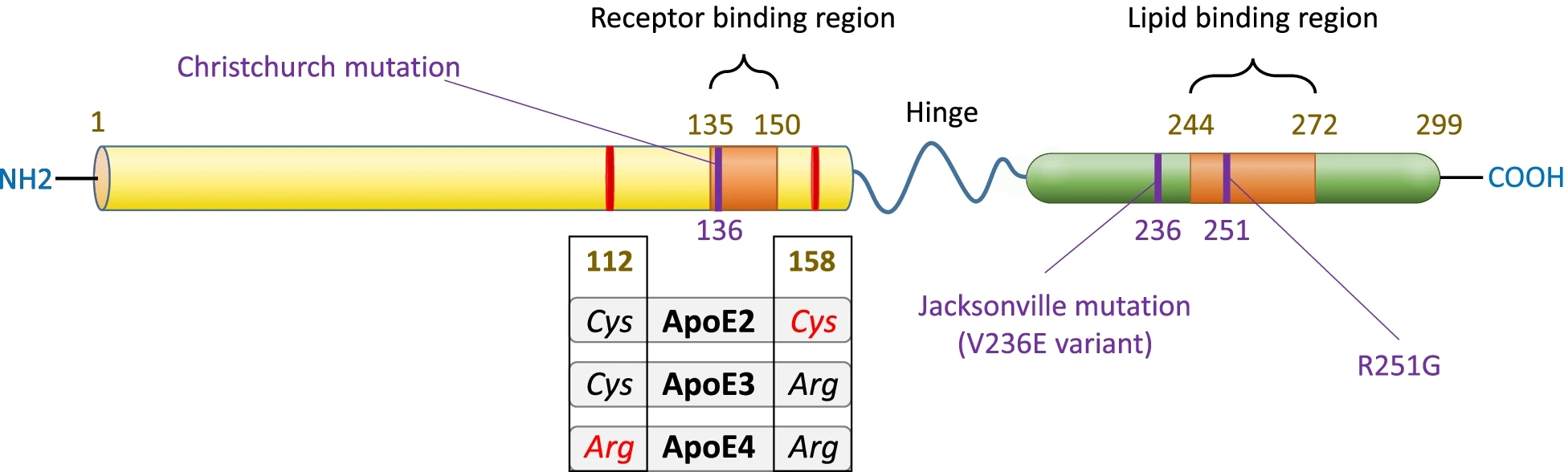
Abbildung 4: Schematische Darstellung der ApoE-Proteinstrukur mit Betrachtung der Änderungen der Aminosäuresequenz durch Polymorphismen und Einteilung in ApoE2, ApoE3 und ApoE4 (adaptiert aus Fernández-Calle et al., 2022)
Die Risikovarianten ApoE2 und ApoE4 erhöhen also vermutlich das Risiko für Herzerkrankungen. Während ApoE2 die atherogenen Lipoproteinwerte erhöht (es bindet schlecht an LDL-Rezeptoren), erhöht ApoE4 die LDL-Werte (es bindet bevorzugt an triglyzeridreiche Lipoproteine mit sehr geringer Dichte, was zu einer Herunterregulierung der LDL-Rezeptoren führt (Mahley, 2016)). Für Träger des ApoE4-Allels ist das Management der Cholesterinwerte entscheidend. Im Folgenden sind einige Strategien aufgeführt.
Einfluss der Ernährung auf die Cholesterinwerte von Risikoallel-Patienten
ApoE4-Träger, die sich reich an gesättigten Fettsäuren, Gesamtfett und Cholesterin ernähren, haben die ungünstigsten Lipidprofile. Diese Patientengruppe profitiert am meisten, wenn sie die Aufnahme dieser Stoffe verringern (Eichner et al., 2002; Gylling & Miettinen, 1992; Lopez-Miranda et al., 1994). Von besonderem Interesse ist, dass die Aufnahme von Omega-3-Fettsäuren und körperliche Aktivität den Einfluss von ApoE4 auf das Risiko für Alzheimer-Krankheit und Herz-Kreislauf-Erkrankungen modifizieren könnten (Bos et al., 2019).
Die Genotypisierung für ApoE könnte dabei helfen, einen gezielten Ansatz zur Krankheitsprävention zu entwickeln. So beschäftigten sich diverse Forschungsgruppen mit dem Einfluss des ApoE-Typus auf den Erfolg von Ernährungsumstellungen für die Prävention von Erkrankungen. Die Einhaltung einer Mittelmeerdiät könnte beispielsweise die Symptome im Zusammenhang mit der Alzheimer-Krankheit verringern, wobei sich stärkere Effekte bei Probanden ohne ApoE4-Genotyp zeigen (Martinez-Lapiscina et al., 2014). Das bestätigte sich in einer weiteren Studie, in der verglichen wurde, wie sich gesunde Lifestyle-Faktoren von ApoE4-Trägern gegenüber Nicht-Trägern auf den kognitiven Abbau auswirken (Dhana et al., 2021). Es zeigte sich, dass sie Gruppe der ApoE4-Träger einen stärkeren kognitiven Verfall erlebte, wobei gesunde Lifestyle-Faktoren mit einer Reduktion dieses Verfalls assoziiert waren. Personen mit der entsprechenden genetischen Prädisposition zeigen also einen stärkeren kognitiven Abfall, dieser war in Verbindung mit gesunden Lifestyle-Faktoren jedoch auch bei ApoE4-Trägern reduziert. Das unterstreicht erneut die Bedeutung der Prävention mittels der Kenntnis über individuelle genetische Merkmale.
Es zeigt sich weiterhin, dass Diäten, die reich an gesättigten Fettsäuren sind, das Alzheimer-Risiko bei ApoE4-Trägern im Vergleich zu Nicht-Trägern um das Siebenfache erhöhen könnten (Kivipelto et al., 2008). Eine Anpassung der Ernährung je nach ApoE-Typus scheint also vielversprechend zu sein.
Bewegung und ApoE
Regelmäßige körperliche Aktivität kann helfen, LDL-Cholesterin zu senken und HDL-Cholesterin zu erhöhen (Liu et al., 2024). Auch bei ApoE3 und E2-Trägern führte körperliche Aktivität zu einem geringerem 18-Jahres-Mortalitätsrisiko, als bei sitzenden Personen (Dankner et al., 2020). Abhängig vom ApoE-Genotyp waren die BMI-Veränderungen bei körperlicher Aktivität in der ApoE4-Gruppe jedoch signifikant höher als in der ApoE3-Gruppe. Gesamtcholesterin, Low-Density-Lipoprotein (LDL) und Triglyceride sanken und High-Density-Lipoprotein (HDL) stieg in beiden Gruppen signifikant an (Lee et al., 2018).
Medikamente bei ApoE-Polymorphismen
In einigen Fällen können Medikamente wie Statine verschrieben werden, um die Cholesterinwerte zu regulieren. Die Wirksamkeit und Notwendigkeit dieser Medikamente kann je nach individuellen Gesundheitsfaktoren und genetischem Profil variieren. Statine werden zur Regulierung des Fettstoffwechsels eingesetzt, da sie den Cholesterinspiegel senken und die Häufigkeit akuter kardiovaskulärer und zerebrovaskulärer Nebenwirkungen verringern. Bei Personen im Alter von 65 Jahren oder älter war eine Behandlung mit Statinen mit einem verringerten Risiko einer Alzheimer-Krankheit verbunden, insbesondere bei ApoE4-Trägern (Rajan et al., 2024). Dabei war die Abnahmerate des Gesamtcholesterins und des LDL als auch die Anstiegsrate von HDL bei ApoE4-Trägern nach der Einnahme von Statinen dennoch viel geringer als bei Nicht-ApoE4-Patienten. Der ApoE-Genpolymorphismus ist somit mit Hyperlipidämie assoziiert und hat einen gewissen Einfluss auf die klinische Wirksamkeit von Statinen bei der Behandlung von Hyperlipidämie (Cai et al., 2021).
Nichtalkoholische Fettleber-Erkrankung (Nonalcoholic fatty liver disease -NAFLD)
Zuletzt soll sich zu dieser Thematik kurz mit den Einflüssen genetischer Polymorphismen auf die Entwicklung einer nicht-alkoholische Fettlebererkrankung (NAFLD) befasst werden. Denn die NAFLD ist eine chronische Erkrankung, die mit genetischen und umweltbedingten Faktoren, Fettleibigkeit, Typ-2-Diabetes und Dyslipidämie in Verbindung steht, bei der sich Fett abnormal in der Leber ansammelt. Derzeit wird die Prävalenz der NAFLD in Deutschland auf etwa 12,25 Millionen Fälle geschätzt, wobei sich dadurch auch eine große wirtschaftliche Last in Höhe von etwa 56 Milliarden Euro pro Jahr ergibt (Younossi et al., 2016). Entsprechend hoch ist der Nutzen einer sinnvollen Risikostratifizierung und auf Basis dessen einer geeigneten Prävention.
Verschiedene genetische Polymorphismen scheinen in diesem Zusammenhang eine Rolle zu spielen (PNPLA3, TM6SF2, PEMT und CHDH-Gene) (Husseini, 2024; Liu et al., 2024; Vasconcellos et al., 2023). In der Datenbank SNPedia werden hier vor allem folgende SNPs in Verbindung mit einer NAFLD gebracht: rs738409 PNPLA3-Gen; rs4880 im SOD2-Gen; rs3750861 im KLF6-Gen; rs13412852 im LPIN1- Gen und rs2854116 und/oder rs2854117 im ApoC3-Gen.
Fazit: Prädiktive Genetik als Werkzeug der Prävention
Die prädiktive Genetik, insbesondere in Kombination mit der Nutrigenetik, bietet ein enormes Potenzial zur Prävention und individuellen Risikobewertung von chronischen Erkrankungen wie Adipositas, Stoffwechselstörungen und Hypercholesterinämie. Durch die Identifikation genetischer Marker, wie Single Nucleotide Polymorphisms (SNPs) im FTO- und ApoE-Gen, können personalisierte Behandlungsstrategien entwickelt und präventive Maßnahmen gezielt eingesetzt werden, bevor sich die Erkrankungen manifestieren sowie das Management dieser Erkrankungen potenziell verbessert werden. Denn die Kenntnis über genetische Prädispositionen ermöglicht es, individuelle Ernährungs- und Lebensstilinterventionen zu gestalten und die allgemeine Gesundheit verbessern – auf eine Art und Weise, die der allgemeinen Prävention potenziell überlegen ist.
Obwohl es noch viele wissenschaftliche Fragen zu klären gibt, zeigt die prädiktive Genetik, dass sie ein nützliches Werkzeug der Präventionsmedizin sein kann.
Prädiktive Genetik: Was Gene über Übergewicht, Cholesterin und den metabolischen Zustand aussagen
Die moderne Medizin steht an der Schwelle zu einem Paradigmenwechsel: Weg von der generischen Behandlung hin zu einer individualisierten Herangehensweise, die auf den genetischen Besonderheiten jedes einzelnen Patienten basiert. Die prädikative Genetik, ein Teilbereich der personalisierten Medizin, ermöglicht es, anhand genetischer Marker, wie den sogenannten Single Nucleotide Polymorphisms (SNPs), Vorhersagen über das Risiko für bestimmte Erkrankungen zu treffen sowie Interventionsmaßnahmen aufzudecken, die dieses Risiko minimieren und die allgemeine Gesundheit verbessern können.
Diese Erkenntnisse könnten also genutzt werden, um präzise Therapien und präventive Maßnahmen zu entwickeln, die auf den individuellen genetischen Hintergrund abgestimmt sind. Dies ermöglicht nicht nur eine gezieltere Behandlung, sondern auch die frühzeitige Identifikation von Risikopatienten. Kann der personalisierte Ansatz also regelhaft in den Praxisalltag eingebunden werden, so verspricht das nicht nur potenziell eine Verbesserung des Behandlungserfolgs, sondern auch einen effektiven Ansatz zur Prävention von Risikopatienten – etwas, was viel diskutiert wird, bei der Umsetzung aber leider oft scheitert.
Ein Teilgebiet, welches im Folgenden genauer beleuchtet werden soll, ist die Nutrigenetik. Es soll darauf geblickt werden, wie dieser Teil der prädiktiven Genetik genutzt werden kann, um das Risiko für häufige Krankheitsbilder wie Adipositas und diverse andere Stoffwechselerkrankungen zu evaluieren und personalisierte Behandlungsstrategien zu entwickeln, wobei kein Anspruch auf Vollständigkeit besteht, sondern lediglich exemplarisch auf die große und zunehmende Rolle genetischer Untersuchungen in der Nutrigenetik hingewiesen werden soll. Erfahren Sie, welche genetischen Marker eine Rolle spielen, wie sie in der Praxis angewendet werden können und welche Vorteile dies für Ihre Patienten bietet.
Was ist Nutrigenetik?
Die Nutrigenetik ist ein Teilgebiet der Genetik, welches die Beziehungen zwischen Genen und Ernährung behandelt. Die Nutrigenetik kann im Zusammenhang mit der prädiktiven Genetik auch als Präzisionsvorbeugung oder Präzisionsernährungstherapie verstanden werden, denn die Diversität der genetischen Profile zwischen Individuen spezifischer ethnischer Gruppen beeinflusst Anforderungen an die Ernährung und den Stoffwechsel sowie Auswirkungen auf die Ernährungstherapie (Ferguson et al., 2016). In Zukunft werden Nutrigenetik und Nutrigenomik mit Daten anderer Omics-Technologien wie Epigenomik, Proteomik, Lipidomik, Foodomics, Metabolomik sowie Mikrobiom- und Datentechnologie kombiniert (Singh, 2023).
Es ist allgemein bekannt und durch zahlreiche Veröffentlichungen belegt, dass eine falsche Ernährung zu verschiedenen Erkrankungen beitragen oder diese verursachen kann. Zu diesen Erkrankungen gehören z. B. Adipositas, Diabetes, Herz-Kreislauf-Erkrankungen, Krebs und Entzündungen (Guevara-Ramirez et al., 2022). Im Speziellen kann eine nutrigenetische Testung genbasierte Ernährungsempfehlungen aussprechen und damit dazu beitragen, Krankheiten zu verhindern oder die Gesundheit zu verbessern (Lal et al., 2022). Das Paradigma der Präzisionsernährung basiert auf der Prämisse, dass erhebliche Unterschiede zwischen Menschen hinsichtlich des ernährungsbedingten Krankheitsrisikos und der Reaktion auf diätetische Interventionen bestehen (Mitchelson et al., 2023).
Nutrigenetische Tests betreffen beispielsweise verschiedene Aspekte im Zusammenhang mit Stoffwechselveränderungen, wie hohem Body Mass Index, zentrale Adipositas, Insulinresistenz, aber auch den zwischen Ernährung und Schlaf oder mit der Appetitregulierung und -kontrolle.

Abbildung 1: Schematische Darstellung des komplexen Ablaufs zur Erstellung personalisierter Behandlungspläne nach dem Prinzip der Präzisionsernährung auf Basis des aktuellen Lifestyles sowie unter Beachtung der genetischen Prädispositionen und weiteren Einflussfaktoren (adaptiert aus Mitchelson et al., 2023)
Weitere Einflüsse der Nutrigenetik lassen sich im Bereich der Nahrungsmittelintoleranzen sowie innerhalb des Stoffwechsels von Vitaminen und Mineralstoffen. Diese werden detailliert auf den Seiten … bis … beleuchtet.
Das FTO-Gen, Adipositas und gängige Polymorphismen
Adipositas ist eine chronische Krankheit, die definiert ist, als eine über das Normalmaß hinausgehende Vermehrung des Körperfetts. Berechnungsgrundlage dafür ist der Body Mass Index (BMI), der einen Quotienten aus Gewicht und Köpergröße zum Quadrat (kg/m2) darstellt. Im Vergleich zum Jahr 1999 stieg die Übergewicht- und Adipositas-Prävalenz in den vergangenen Jahren deutlich an. In Deutschland sind 2022 insgesamt 53,5 % der Bevölkerung (46,6% der Frauen und 60,5% der Männer) von Übergewicht (einschließlich Adipositas) betroffen. Bei 19,0% der Erwachsenen liegt eine Adipositas vor (Schienkiewitz et al., 2022). Es besteht also akuter Handlungs- und Präventionsbedarf, denn die Zahl an mit Übergewicht und Adipositas assoziierten Erkrankungen ist groß.

Abbildung 2: Übergewicht- und Adipositas-Prävalenz der Erwachsenen in Deutschland, Verteilung nach Alter und Geschlecht (adaptiert aus Schienkiewitz et al., 2022)
Durch genomweite Assoziationsstudien wurden zahlreiche mit Adipositas in Zusammenhang stehende Genloci identifiziert. Dabei war das Fettmasse- und Adipositas-assoziierte Gen (FTO-Gen), welches auf dem Chromosom 16q12.2 lokalisiert ist (9 Exons und 8 Introns), eines der ersten und am besten beschriebenen Adipositas-assoziierten Gene (Loos, 2012).
Funktionell ist das Produkt des FTO-Gens ein Enzym mit mRNA-Demethylasefunktion (v. a. N6-(Di-)Methyladenosin-Demethylase; m6A-Demethylase). Zahlreiche zelluläre Prozesse werden durch m6A-Modifikation moduliert, darunter alternatives Spleißen, mRNA-Stabilität, Translation, Transport, Abbau und Genregulation, das Ungleichgewicht von m6A wurde mit daher verschiedenen Erkrankungen in Verbindung gebracht, darunter Fettleibigkeit, Diabetes, Herzversagen, Hirnerkrankungen und verschiedene Tumore (Azzam et al., 2022).
Interessanterweise könnte das FTO-Gen so eine gemeinsame genetische Grundlage für die Zunahme von Fettleibigkeit und Krebs bilden (Lan et al., 2020). Adipositas erhöht das Krebsrisiko bei mindestens 13 Krebsarten (Goodwin & Stambolic, 2015) und steht weiterhin in einem engen Zusammenhang mit einem breiten Spektrum teils pathologischer Verhaltensauffälligkeiten, wie z. B. Aufmerksamkeitsdefiziten, affektiven Symptomen und Drogenmissbrauch (Hess & Bruning, 2014) und auch von Herz-Kreislauf-Erkrankungen (Liu et al., 2013; Xu et al., 2023). Eine Betrachtung des FTO-Gens und der relevanten SNPs in diesem Zusammenhang hat also auch aus dieser Perspektive eine potenzielle Relevanz in der Prävention.
FTO-SNP rs9939609 (T/A)
Der klassische BMI-bezogene FTO-SNPs war rs9939609 (T/A). 16 % der Erwachsenen, die das homozygote Risikoallel (AA) trugen, nahmen fast 3 kg an Gewicht zu und das Risiko für eine Fettleibigkeit stieg um das 1,67-Fache (Frayling et al., 2007). Menschen mit FTO-Risiko-Allelen neigen zu einer energiereicheren Ernährung und einem verringerten Sättigungsgefühl und können die Kontrolle über das Essen verlieren (Ahmad et al., 2011; Cecil et al., 2008; Sonestedt et al., 2009; Tanofsky-Kraff et al., 2009). Genomweite Assoziationsstudien (GWAS) haben Varianten innerhalb von Introns von FTO reproduzierbar mit einem erhöhten Risiko für Fettleibigkeit und Typ-2-Diabetes in Verbindung gebracht (Dina et al., 2007; Frayling et al., 2007; Scuteri et al., 2007).
Dieser SNP wird weiterhin mit einem erhöhten BMI oder erhöhter Energieaufnahme (Speakman et al., 2008) bei Europäern, Brasilianer und Chinesen in Verbindung gebracht (da Fonseca et al., 2019; Jiang et al., 2019; Mehrdad et al., 2020). Bei erwachsenen Menschen konnte gezeigt werden, dass diese mit den gefährdeten AT- und AA-Allelen täglich zwischen 500 und 1250 kJ mehr zu sich nahmen als Träger des schützenden TT-Genotyps (Speakman et al., 2008). Der Genotyp FTO rs9939609 wurde außerdem mit einer erhöhten Expression des Hormons Ghrelin in Verbindung gebracht, welches das Verdauungsverhalten reguliert und zu einer erhöhten Aufnahme von kalorienreicheren Lebensmitteln führt (Karra et al., 2013).
Das menschliche FTO-Gen mit den genetischen Varianten rs9939609 und rs9930506, die beide im Intron 1 sind, trägt zudem erheblich zur frühen Entstehung des metabolischen Syndroms bei Kindern und Jugendlichen bei (Song et al., 2023). Die mit Fettleibigkeit verbundene nicht-kodierende Region innerhalb des FTO-Gens (Introns) interagiert direkt mit dem Promotor von IRX3 und IRX5, die ebenfalls mit Fettleibigkeit in Verbindung stehen (Smemo et al., 2014). Mit Fettleibigkeit assoziierte FTO-SNPs im Intron 1 (wie rs9939609, aber auch rs17817449, rs3751812, rs1421085, rs9930506 und rs7202116) weisen insgesamt eine starke Assoziation mit Übergewicht oder Fettleibigkeit auf.

Abbildung 3: Schematische Darstellung des Einflusses verschiedener SNPs im Bereich des Intron 1 des FTO-Gens auf die Expression anderer Gene; diese zusätzliche Regulation ist ein Ansatzpunkt zur Erklärung der Assoziation der FTO-SNPs mit Übergewicht und Krebs (adaptiert aus Lan et al., 2020)
Die Ergebnisse deuten zwar klar auf den Zusammenhang des Risikoallels von rs9939609, das Ausmaß und der Eintritt der Adipositas ist jedoch vermutlich abhängig vom Lebensstil der Individuen. Eine groß angelegte Metaanalyse (218.166 Erwachsene und 19.268 Kinder) zeigte, dass das homozygote FTO-Risikoallel (rs9939609) mit einem um 27 % geringeren Risiko für Fettleibigkeit bei körperlich aktiven Erwachsenen verbunden war, im Vergleich zu jenen, die inaktiv waren und das Risikoallel trugen (Kilpelainen et al., 2011). Diese Ergebnisse wurden kürzlich bestätigt und erneut auf die Notwendigkeit einer erhöhten körperlichen Aktivität bei Personen mit dem Risikophänotyp (rs9939609) hingewiesen (Martinez-Lopez et al., 2024). Epigenetische Einflüsse auf das FTO-Gen werden als neuer Ansatz in der Behandlung der Adipositas abhängig vom Einzelnukleotid-Polymorphismus diskutiert (Popovic et al., 2023).
Nicht nur der klassische Polymorphismus rs9939609 zeigt Assoziationen mit der Entstehung von Übergewicht und Adipositas. Auch andere SNPs, besonders jene, die sich im Intron 1 befinden, zeigen sich als relevant. Daher sollen im Folgenden auch die weiteren SNPs kurz aufgeführt werden.
Weitere FTO-SNPs
Der Polymorphismus rs9930506 ist sowohl bei Europäern und verschiedenen anderen Ethnien (z.B. Asiaten) mit der Gewichtsregulation und einem erhöhten BMI assoziiert (Cauchi et al., 2009; Chang et al., 2008; Dina et al., 2007; Haupt et al., 2008; Scuteri et al., 2007). Auch die SNPs rs1421085, rs8050136 und rs1121980 sind bei Europäern mit einer Adipositas verbunden (Cauchi et al., 2009; Dina et al., 2007; Haupt et al., 2008; Scuteri et al., 2007).
Je nach Abstammung unterscheidet sich der Einfluss eines SNPs auf die Entwicklung von Übergewicht und Adipositas. Der SNP rs17817449 zeigt beispielsweise besonders bei Menschen mit chinesischer Abstammung eine hohe Korrelation mit dem BMI (Wen et al., 2012).
FTO-Gen und weitere Pathologien
Einige Polymophismen des FTO-Gens (rs9939609, rs8050136, rs1477196, rs6499640, rs1121980, rs17817449, rs11075995, rs8047395 und rs7206790) sind mit einem höheren Krebsrisiko verbunden (Hernandez-Caballero & Sierra-Ramirez, 2015).
Der typischste FTO-SNP rs9939609 wurde mit Lungenkrebs, Nierenkrebs, Brustkrebs, Prostatakrebs, Bauchspeicheldrüsenkrebs und Gebärmutterkrebs in Verbindung gebracht (Delahanty et al., 2011; Kaklamani et al., 2011; Lin et al., 2013). Allerdings wurde eine Schutzfunktion des AG-Genotyps (rs9930506) gegen das Bronchialkarzinom postuliert (Hernandez-Caballero et al., 2024).
Jüngste Studien haben zudem gezeigt, dass das FTO-Gen eine entscheidende Rolle bei der Entstehung und dem Fortschreiten von Herz-Kreislauf-Erkrankungen wie Myokardfibrose, Herzinsuffizienz und Arteriosklerose spielt (Xu et al., 2023).
Es bleibt also spannend um die Einflüsse des FTO-Gens, die vermutlich weit über das metabolische Syndrom und Adipositas hinausreichen. Im Kontext der Prävention kann anhand einer Bestimmung eventueller Polymorphismen des FTO-Gens gegebenenfalls eine Optimierung des Lebensstils erfolgen, beispielsweise hinsichtlich der Ernährung und körperlicher Betätigung.
ApoE-Gen: Einfluss von Genpolymorphismen auf den Lipidstoffwechsel
Ein weiteres Gen, das es in diesem Kontext zu erwähnen gilt, ist das ApoE und die entsprechenden Polymorphismen. Das ApoE kodierende Gen ApoE befindet sich auf Chromosom 19q13.2 und enthält vier Exons und drei Introns (Marais, 2019). Apolipoprotein E (ApoE) ist ein ubiquitäres Lipidtransportprotein, das eine Vielzahl von Lipidspezies bindet, darunter Cholesterin, Phospholipide und Triglyceride in Lipoproteinpartikeln (Mahley et al., 2009). Das ApoE ein Protein mit einer zentralen Rolle im Cholesterol- und Lipid-Transport und -Stoffwechsel (Mahley, 1988).
Das Protein ApoE transportiert Triglyzeride, fettlösliche Vitamine und Cholesterin zuerst in die Lymphbahn und dann ins Blut. Das ApoE-Gen existiert in drei Hauptallelen: ApoE2, ApoE3 und ApoE4. Bei 3 Genvarianten ergeben sich, da je eine Kopie von jedem Elternteil weitergegeben wird, 6 Genotypen (Apo E2/E2, Apo E2/E3, Apo E2/E4, Apo E3/E3, Apo E3/E4 und Apo E4/E4). Der häufigste Genotyp ist E3/E3.
Dass ApoE4-Träger ein erhöhtes Risiko haben, am M. Alzheimer zu erkranken, ist bekannt. Diese verschiedenen ApoE-Allele beeinflussen allerdings auch, wie Cholesterin und andere Lipide im Körper verstoffwechselt werden. Dies spielt für das Auftreten von Herz-Kreislauf-Erkrankungen eine entscheidende Rolle, denn Dyslipidämie ist eine der Ursachen für die koronare Herzkrankheiten (KHK) und ApoE-Genpolymorphismen beeinflussen den Lipidspiegel.
Im Vergleich zu ApoE3 ist ApoE4 beispielsweise mit einem erhöhten Risiko für nicht-neurologische Erkrankungen wie Hypercholesterinämie, Hypertriglyzeridämie und Herz-Kreislauf-Erkrankungen verbunden (Bennet et al., 2007; Carvalho-Wells et al., 2012; Dallongeville et al., 1992). Es besteht ein signifikanter Zusammenhang zwischen dem ApoE4-Allel und einer Hypercholesterinämie (Lozano et al., 2021). Die Auswirkungen von ApoE4 Trägern auf das LDL-Cholesterin (höheres Gesamt- und LDL-Cholesterin und niedrigeres HDL-Cholesterin) werden ausführlich bei Dunk et al. 2023 (Dunk et al., 2023) diskutiert.
Ein erhöhtes LDL-Cholesterin ist ein bekannter Risikofaktor für Arteriosklerose, Herz-Kreislauf-Erkrankungen wie Herzkrankheiten und Schlaganfälle (Mahley, 2016; Mahley & Rall, 2000; Mahley et al., 2009). Es konnte gezeigt werden, dass ApoE4 zu einer vorzeitigen KHK führt (Zhao et al., 2017). Allerdings sind die Aussagen nicht einheitlich. Die Ergebnisse einer Metaanalyse legen nahe, dass verschiedene ApoE-Allele in verschiedenen Ethnien zu unterschiedlichen Effekten führen könnten, so ist das ApoE2-Allel bei Asiaten ein Risikofaktor für eine vorzeitige koronare Herzerkrankung, während es bei Kaukasiern einen Schutzfaktor darstellen könnte (Zhao et al., 2017). ApoE2 bindet jedoch fehlerhaft an den LDL-Rezeptor (ca. 2 % der normalen Aktivität), da es an Position 158 einen Cysteinrest statt eines Argininrests wie ApoE3 und ApoE4 aufweist (Mahley, 2016). Wegen fehlerhafter Bindung an LDL-Rezeptoren kann die Homozygotie von ApoE2 eine Hyperlipoproteinämie Typ III auslösen, jedoch nur, wenn eine andere Erkrankung zu einer Überproduktion von VLDL oder zu weniger LDL-Rezeptoren führen (Mahley et al., 1999; Mahley & Rall, 2000).

Abbildung 4: Schematische Darstellung der ApoE-Proteinstrukur mit Betrachtung der Änderungen der Aminosäuresequenz durch Polymorphismen und Einteilung in ApoE2, ApoE3 und ApoE4 (adaptiert aus Fernández-Calle et al., 2022)
Die Risikovarianten ApoE2 und ApoE4 erhöhen also vermutlich das Risiko für Herzerkrankungen. Während ApoE2 die atherogenen Lipoproteinwerte erhöht (es bindet schlecht an LDL-Rezeptoren), erhöht ApoE4 die LDL-Werte (es bindet bevorzugt an triglyzeridreiche Lipoproteine mit sehr geringer Dichte, was zu einer Herunterregulierung der LDL-Rezeptoren führt (Mahley, 2016)). Für Träger des ApoE4-Allels ist das Management der Cholesterinwerte entscheidend. Im Folgenden sind einige Strategien aufgeführt.
Einfluss der Ernährung auf die Cholesterinwerte von Risikoallel-Patienten
ApoE4-Träger, die sich reich an gesättigten Fettsäuren, Gesamtfett und Cholesterin ernähren, haben die ungünstigsten Lipidprofile. Diese Patientengruppe profitiert am meisten, wenn sie die Aufnahme dieser Stoffe verringern (Eichner et al., 2002; Gylling & Miettinen, 1992; Lopez-Miranda et al., 1994). Von besonderem Interesse ist, dass die Aufnahme von Omega-3-Fettsäuren und körperliche Aktivität den Einfluss von ApoE4 auf das Risiko für Alzheimer-Krankheit und Herz-Kreislauf-Erkrankungen modifizieren könnten (Bos et al., 2019).
Die Genotypisierung für ApoE könnte dabei helfen, einen gezielten Ansatz zur Krankheitsprävention zu entwickeln. So beschäftigten sich diverse Forschungsgruppen mit dem Einfluss des ApoE-Typus auf den Erfolg von Ernährungsumstellungen für die Prävention von Erkrankungen. Die Einhaltung einer Mittelmeerdiät könnte beispielsweise die Symptome im Zusammenhang mit der Alzheimer-Krankheit verringern, wobei sich stärkere Effekte bei Probanden ohne ApoE4-Genotyp zeigen (Martinez-Lapiscina et al., 2014). Das bestätigte sich in einer weiteren Studie, in der verglichen wurde, wie sich gesunde Lifestyle-Faktoren von ApoE4-Trägern gegenüber Nicht-Trägern auf den kognitiven Abbau auswirken (Dhana et al., 2021). Es zeigte sich, dass sie Gruppe der ApoE4-Träger einen stärkeren kognitiven Verfall erlebte, wobei gesunde Lifestyle-Faktoren mit einer Reduktion dieses Verfalls assoziiert waren. Personen mit der entsprechenden genetischen Prädisposition zeigen also einen stärkeren kognitiven Abfall, dieser war in Verbindung mit gesunden Lifestyle-Faktoren jedoch auch bei ApoE4-Trägern reduziert. Das unterstreicht erneut die Bedeutung der Prävention mittels der Kenntnis über individuelle genetische Merkmale.
Es zeigt sich weiterhin, dass Diäten, die reich an gesättigten Fettsäuren sind, das Alzheimer-Risiko bei ApoE4-Trägern im Vergleich zu Nicht-Trägern um das Siebenfache erhöhen könnten (Kivipelto et al., 2008). Eine Anpassung der Ernährung je nach ApoE-Typus scheint also vielversprechend zu sein.
Bewegung und ApoE
Regelmäßige körperliche Aktivität kann helfen, LDL-Cholesterin zu senken und HDL-Cholesterin zu erhöhen (Liu et al., 2024). Auch bei ApoE3 und E2-Trägern führte körperliche Aktivität zu einem geringerem 18-Jahres-Mortalitätsrisiko, als bei sitzenden Personen (Dankner et al., 2020). Abhängig vom ApoE-Genotyp waren die BMI-Veränderungen bei körperlicher Aktivität in der ApoE4-Gruppe jedoch signifikant höher als in der ApoE3-Gruppe. Gesamtcholesterin, Low-Density-Lipoprotein (LDL) und Triglyceride sanken und High-Density-Lipoprotein (HDL) stieg in beiden Gruppen signifikant an (Lee et al., 2018).
Medikamente bei ApoE-Polymorphismen
In einigen Fällen können Medikamente wie Statine verschrieben werden, um die Cholesterinwerte zu regulieren. Die Wirksamkeit und Notwendigkeit dieser Medikamente kann je nach individuellen Gesundheitsfaktoren und genetischem Profil variieren. Statine werden zur Regulierung des Fettstoffwechsels eingesetzt, da sie den Cholesterinspiegel senken und die Häufigkeit akuter kardiovaskulärer und zerebrovaskulärer Nebenwirkungen verringern. Bei Personen im Alter von 65 Jahren oder älter war eine Behandlung mit Statinen mit einem verringerten Risiko einer Alzheimer-Krankheit verbunden, insbesondere bei ApoE4-Trägern (Rajan et al., 2024). Dabei war die Abnahmerate des Gesamtcholesterins und des LDL als auch die Anstiegsrate von HDL bei ApoE4-Trägern nach der Einnahme von Statinen dennoch viel geringer als bei Nicht-ApoE4-Patienten. Der ApoE-Genpolymorphismus ist somit mit Hyperlipidämie assoziiert und hat einen gewissen Einfluss auf die klinische Wirksamkeit von Statinen bei der Behandlung von Hyperlipidämie (Cai et al., 2021).
Nichtalkoholische Fettleber-Erkrankung (Nonalcoholic fatty liver disease -NAFLD)
Zuletzt soll sich zu dieser Thematik kurz mit den Einflüssen genetischer Polymorphismen auf die Entwicklung einer nicht-alkoholische Fettlebererkrankung (NAFLD) befasst werden. Denn die NAFLD ist eine chronische Erkrankung, die mit genetischen und umweltbedingten Faktoren, Fettleibigkeit, Typ-2-Diabetes und Dyslipidämie in Verbindung steht, bei der sich Fett abnormal in der Leber ansammelt. Derzeit wird die Prävalenz der NAFLD in Deutschland auf etwa 12,25 Millionen Fälle geschätzt, wobei sich dadurch auch eine große wirtschaftliche Last in Höhe von etwa 56 Milliarden Euro pro Jahr ergibt (Younossi et al., 2016). Entsprechend hoch ist der Nutzen einer sinnvollen Risikostratifizierung und auf Basis dessen einer geeigneten Prävention.
Verschiedene genetische Polymorphismen scheinen in diesem Zusammenhang eine Rolle zu spielen (PNPLA3, TM6SF2, PEMT und CHDH-Gene) (Husseini, 2024; Liu et al., 2024; Vasconcellos et al., 2023). In der Datenbank SNPedia werden hier vor allem folgende SNPs in Verbindung mit einer NAFLD gebracht: rs738409 PNPLA3-Gen; rs4880 im SOD2-Gen; rs3750861 im KLF6-Gen; rs13412852 im LPIN1- Gen und rs2854116 und/oder rs2854117 im ApoC3-Gen.
Fazit: Prädiktive Genetik als Werkzeug der Prävention
Die prädiktive Genetik, insbesondere in Kombination mit der Nutrigenetik, bietet ein enormes Potenzial zur Prävention und individuellen Risikobewertung von chronischen Erkrankungen wie Adipositas, Stoffwechselstörungen und Hypercholesterinämie. Durch die Identifikation genetischer Marker, wie Single Nucleotide Polymorphisms (SNPs) im FTO- und ApoE-Gen, können personalisierte Behandlungsstrategien entwickelt und präventive Maßnahmen gezielt eingesetzt werden, bevor sich die Erkrankungen manifestieren sowie das Management dieser Erkrankungen potenziell verbessert werden. Denn die Kenntnis über genetische Prädispositionen ermöglicht es, individuelle Ernährungs- und Lebensstilinterventionen zu gestalten und die allgemeine Gesundheit verbessern – auf eine Art und Weise, die der allgemeinen Prävention potenziell überlegen ist.
Obwohl es noch viele wissenschaftliche Fragen zu klären gibt, zeigt die prädiktive Genetik, dass sie ein nützliches Werkzeug der Präventionsmedizin sein kann.
Prädiktive Genetik: Was Gene über Übergewicht, Cholesterin und den metabolischen Zustand aussagen
Die moderne Medizin steht an der Schwelle zu einem Paradigmenwechsel: Weg von der generischen Behandlung hin zu einer individualisierten Herangehensweise, die auf den genetischen Besonderheiten jedes einzelnen Patienten basiert. Die prädikative Genetik, ein Teilbereich der personalisierten Medizin, ermöglicht es, anhand genetischer Marker, wie den sogenannten Single Nucleotide Polymorphisms (SNPs), Vorhersagen über das Risiko für bestimmte Erkrankungen zu treffen sowie Interventionsmaßnahmen aufzudecken, die dieses Risiko minimieren und die allgemeine Gesundheit verbessern können.
Diese Erkenntnisse könnten also genutzt werden, um präzise Therapien und präventive Maßnahmen zu entwickeln, die auf den individuellen genetischen Hintergrund abgestimmt sind. Dies ermöglicht nicht nur eine gezieltere Behandlung, sondern auch die frühzeitige Identifikation von Risikopatienten. Kann der personalisierte Ansatz also regelhaft in den Praxisalltag eingebunden werden, so verspricht das nicht nur potenziell eine Verbesserung des Behandlungserfolgs, sondern auch einen effektiven Ansatz zur Prävention von Risikopatienten – etwas, was viel diskutiert wird, bei der Umsetzung aber leider oft scheitert.
Ein Teilgebiet, welches im Folgenden genauer beleuchtet werden soll, ist die Nutrigenetik. Es soll darauf geblickt werden, wie dieser Teil der prädiktiven Genetik genutzt werden kann, um das Risiko für häufige Krankheitsbilder wie Adipositas und diverse andere Stoffwechselerkrankungen zu evaluieren und personalisierte Behandlungsstrategien zu entwickeln, wobei kein Anspruch auf Vollständigkeit besteht, sondern lediglich exemplarisch auf die große und zunehmende Rolle genetischer Untersuchungen in der Nutrigenetik hingewiesen werden soll. Erfahren Sie, welche genetischen Marker eine Rolle spielen, wie sie in der Praxis angewendet werden können und welche Vorteile dies für Ihre Patienten bietet.
Was ist Nutrigenetik?
Die Nutrigenetik ist ein Teilgebiet der Genetik, welches die Beziehungen zwischen Genen und Ernährung behandelt. Die Nutrigenetik kann im Zusammenhang mit der prädiktiven Genetik auch als Präzisionsvorbeugung oder Präzisionsernährungstherapie verstanden werden, denn die Diversität der genetischen Profile zwischen Individuen spezifischer ethnischer Gruppen beeinflusst Anforderungen an die Ernährung und den Stoffwechsel sowie Auswirkungen auf die Ernährungstherapie (Ferguson et al., 2016). In Zukunft werden Nutrigenetik und Nutrigenomik mit Daten anderer Omics-Technologien wie Epigenomik, Proteomik, Lipidomik, Foodomics, Metabolomik sowie Mikrobiom- und Datentechnologie kombiniert (Singh, 2023).
Es ist allgemein bekannt und durch zahlreiche Veröffentlichungen belegt, dass eine falsche Ernährung zu verschiedenen Erkrankungen beitragen oder diese verursachen kann. Zu diesen Erkrankungen gehören z. B. Adipositas, Diabetes, Herz-Kreislauf-Erkrankungen, Krebs und Entzündungen (Guevara-Ramirez et al., 2022). Im Speziellen kann eine nutrigenetische Testung genbasierte Ernährungsempfehlungen aussprechen und damit dazu beitragen, Krankheiten zu verhindern oder die Gesundheit zu verbessern (Lal et al., 2022). Das Paradigma der Präzisionsernährung basiert auf der Prämisse, dass erhebliche Unterschiede zwischen Menschen hinsichtlich des ernährungsbedingten Krankheitsrisikos und der Reaktion auf diätetische Interventionen bestehen (Mitchelson et al., 2023).
Nutrigenetische Tests betreffen beispielsweise verschiedene Aspekte im Zusammenhang mit Stoffwechselveränderungen, wie hohem Body Mass Index, zentrale Adipositas, Insulinresistenz, aber auch den zwischen Ernährung und Schlaf oder mit der Appetitregulierung und -kontrolle.

Abbildung 1: Schematische Darstellung des komplexen Ablaufs zur Erstellung personalisierter Behandlungspläne nach dem Prinzip der Präzisionsernährung auf Basis des aktuellen Lifestyles sowie unter Beachtung der genetischen Prädispositionen und weiteren Einflussfaktoren (adaptiert aus Mitchelson et al., 2023)
Weitere Einflüsse der Nutrigenetik lassen sich im Bereich der Nahrungsmittelintoleranzen sowie innerhalb des Stoffwechsels von Vitaminen und Mineralstoffen. Diese werden detailliert auf den Seiten … bis … beleuchtet.
Das FTO-Gen, Adipositas und gängige Polymorphismen
Adipositas ist eine chronische Krankheit, die definiert ist, als eine über das Normalmaß hinausgehende Vermehrung des Körperfetts. Berechnungsgrundlage dafür ist der Body Mass Index (BMI), der einen Quotienten aus Gewicht und Köpergröße zum Quadrat (kg/m2) darstellt. Im Vergleich zum Jahr 1999 stieg die Übergewicht- und Adipositas-Prävalenz in den vergangenen Jahren deutlich an. In Deutschland sind 2022 insgesamt 53,5 % der Bevölkerung (46,6% der Frauen und 60,5% der Männer) von Übergewicht (einschließlich Adipositas) betroffen. Bei 19,0% der Erwachsenen liegt eine Adipositas vor (Schienkiewitz et al., 2022). Es besteht also akuter Handlungs- und Präventionsbedarf, denn die Zahl an mit Übergewicht und Adipositas assoziierten Erkrankungen ist groß.

Abbildung 2: Übergewicht- und Adipositas-Prävalenz der Erwachsenen in Deutschland, Verteilung nach Alter und Geschlecht (adaptiert aus Schienkiewitz et al., 2022)
Durch genomweite Assoziationsstudien wurden zahlreiche mit Adipositas in Zusammenhang stehende Genloci identifiziert. Dabei war das Fettmasse- und Adipositas-assoziierte Gen (FTO-Gen), welches auf dem Chromosom 16q12.2 lokalisiert ist (9 Exons und 8 Introns), eines der ersten und am besten beschriebenen Adipositas-assoziierten Gene (Loos, 2012).
Funktionell ist das Produkt des FTO-Gens ein Enzym mit mRNA-Demethylasefunktion (v. a. N6-(Di-)Methyladenosin-Demethylase; m6A-Demethylase). Zahlreiche zelluläre Prozesse werden durch m6A-Modifikation moduliert, darunter alternatives Spleißen, mRNA-Stabilität, Translation, Transport, Abbau und Genregulation, das Ungleichgewicht von m6A wurde mit daher verschiedenen Erkrankungen in Verbindung gebracht, darunter Fettleibigkeit, Diabetes, Herzversagen, Hirnerkrankungen und verschiedene Tumore (Azzam et al., 2022).
Interessanterweise könnte das FTO-Gen so eine gemeinsame genetische Grundlage für die Zunahme von Fettleibigkeit und Krebs bilden (Lan et al., 2020). Adipositas erhöht das Krebsrisiko bei mindestens 13 Krebsarten (Goodwin & Stambolic, 2015) und steht weiterhin in einem engen Zusammenhang mit einem breiten Spektrum teils pathologischer Verhaltensauffälligkeiten, wie z. B. Aufmerksamkeitsdefiziten, affektiven Symptomen und Drogenmissbrauch (Hess & Bruning, 2014) und auch von Herz-Kreislauf-Erkrankungen (Liu et al., 2013; Xu et al., 2023). Eine Betrachtung des FTO-Gens und der relevanten SNPs in diesem Zusammenhang hat also auch aus dieser Perspektive eine potenzielle Relevanz in der Prävention.
FTO-SNP rs9939609 (T/A)
Der klassische BMI-bezogene FTO-SNPs war rs9939609 (T/A). 16 % der Erwachsenen, die das homozygote Risikoallel (AA) trugen, nahmen fast 3 kg an Gewicht zu und das Risiko für eine Fettleibigkeit stieg um das 1,67-Fache (Frayling et al., 2007). Menschen mit FTO-Risiko-Allelen neigen zu einer energiereicheren Ernährung und einem verringerten Sättigungsgefühl und können die Kontrolle über das Essen verlieren (Ahmad et al., 2011; Cecil et al., 2008; Sonestedt et al., 2009; Tanofsky-Kraff et al., 2009). Genomweite Assoziationsstudien (GWAS) haben Varianten innerhalb von Introns von FTO reproduzierbar mit einem erhöhten Risiko für Fettleibigkeit und Typ-2-Diabetes in Verbindung gebracht (Dina et al., 2007; Frayling et al., 2007; Scuteri et al., 2007).
Dieser SNP wird weiterhin mit einem erhöhten BMI oder erhöhter Energieaufnahme (Speakman et al., 2008) bei Europäern, Brasilianer und Chinesen in Verbindung gebracht (da Fonseca et al., 2019; Jiang et al., 2019; Mehrdad et al., 2020). Bei erwachsenen Menschen konnte gezeigt werden, dass diese mit den gefährdeten AT- und AA-Allelen täglich zwischen 500 und 1250 kJ mehr zu sich nahmen als Träger des schützenden TT-Genotyps (Speakman et al., 2008). Der Genotyp FTO rs9939609 wurde außerdem mit einer erhöhten Expression des Hormons Ghrelin in Verbindung gebracht, welches das Verdauungsverhalten reguliert und zu einer erhöhten Aufnahme von kalorienreicheren Lebensmitteln führt (Karra et al., 2013).
Das menschliche FTO-Gen mit den genetischen Varianten rs9939609 und rs9930506, die beide im Intron 1 sind, trägt zudem erheblich zur frühen Entstehung des metabolischen Syndroms bei Kindern und Jugendlichen bei (Song et al., 2023). Die mit Fettleibigkeit verbundene nicht-kodierende Region innerhalb des FTO-Gens (Introns) interagiert direkt mit dem Promotor von IRX3 und IRX5, die ebenfalls mit Fettleibigkeit in Verbindung stehen (Smemo et al., 2014). Mit Fettleibigkeit assoziierte FTO-SNPs im Intron 1 (wie rs9939609, aber auch rs17817449, rs3751812, rs1421085, rs9930506 und rs7202116) weisen insgesamt eine starke Assoziation mit Übergewicht oder Fettleibigkeit auf.

Abbildung 3: Schematische Darstellung des Einflusses verschiedener SNPs im Bereich des Intron 1 des FTO-Gens auf die Expression anderer Gene; diese zusätzliche Regulation ist ein Ansatzpunkt zur Erklärung der Assoziation der FTO-SNPs mit Übergewicht und Krebs (adaptiert aus Lan et al., 2020)
Die Ergebnisse deuten zwar klar auf den Zusammenhang des Risikoallels von rs9939609, das Ausmaß und der Eintritt der Adipositas ist jedoch vermutlich abhängig vom Lebensstil der Individuen. Eine groß angelegte Metaanalyse (218.166 Erwachsene und 19.268 Kinder) zeigte, dass das homozygote FTO-Risikoallel (rs9939609) mit einem um 27 % geringeren Risiko für Fettleibigkeit bei körperlich aktiven Erwachsenen verbunden war, im Vergleich zu jenen, die inaktiv waren und das Risikoallel trugen (Kilpelainen et al., 2011). Diese Ergebnisse wurden kürzlich bestätigt und erneut auf die Notwendigkeit einer erhöhten körperlichen Aktivität bei Personen mit dem Risikophänotyp (rs9939609) hingewiesen (Martinez-Lopez et al., 2024). Epigenetische Einflüsse auf das FTO-Gen werden als neuer Ansatz in der Behandlung der Adipositas abhängig vom Einzelnukleotid-Polymorphismus diskutiert (Popovic et al., 2023).
Nicht nur der klassische Polymorphismus rs9939609 zeigt Assoziationen mit der Entstehung von Übergewicht und Adipositas. Auch andere SNPs, besonders jene, die sich im Intron 1 befinden, zeigen sich als relevant. Daher sollen im Folgenden auch die weiteren SNPs kurz aufgeführt werden.
Weitere FTO-SNPs
Der Polymorphismus rs9930506 ist sowohl bei Europäern und verschiedenen anderen Ethnien (z.B. Asiaten) mit der Gewichtsregulation und einem erhöhten BMI assoziiert (Cauchi et al., 2009; Chang et al., 2008; Dina et al., 2007; Haupt et al., 2008; Scuteri et al., 2007). Auch die SNPs rs1421085, rs8050136 und rs1121980 sind bei Europäern mit einer Adipositas verbunden (Cauchi et al., 2009; Dina et al., 2007; Haupt et al., 2008; Scuteri et al., 2007).
Je nach Abstammung unterscheidet sich der Einfluss eines SNPs auf die Entwicklung von Übergewicht und Adipositas. Der SNP rs17817449 zeigt beispielsweise besonders bei Menschen mit chinesischer Abstammung eine hohe Korrelation mit dem BMI (Wen et al., 2012).
FTO-Gen und weitere Pathologien
Einige Polymophismen des FTO-Gens (rs9939609, rs8050136, rs1477196, rs6499640, rs1121980, rs17817449, rs11075995, rs8047395 und rs7206790) sind mit einem höheren Krebsrisiko verbunden (Hernandez-Caballero & Sierra-Ramirez, 2015).
Der typischste FTO-SNP rs9939609 wurde mit Lungenkrebs, Nierenkrebs, Brustkrebs, Prostatakrebs, Bauchspeicheldrüsenkrebs und Gebärmutterkrebs in Verbindung gebracht (Delahanty et al., 2011; Kaklamani et al., 2011; Lin et al., 2013). Allerdings wurde eine Schutzfunktion des AG-Genotyps (rs9930506) gegen das Bronchialkarzinom postuliert (Hernandez-Caballero et al., 2024).
Jüngste Studien haben zudem gezeigt, dass das FTO-Gen eine entscheidende Rolle bei der Entstehung und dem Fortschreiten von Herz-Kreislauf-Erkrankungen wie Myokardfibrose, Herzinsuffizienz und Arteriosklerose spielt (Xu et al., 2023).
Es bleibt also spannend um die Einflüsse des FTO-Gens, die vermutlich weit über das metabolische Syndrom und Adipositas hinausreichen. Im Kontext der Prävention kann anhand einer Bestimmung eventueller Polymorphismen des FTO-Gens gegebenenfalls eine Optimierung des Lebensstils erfolgen, beispielsweise hinsichtlich der Ernährung und körperlicher Betätigung.
ApoE-Gen: Einfluss von Genpolymorphismen auf den Lipidstoffwechsel
Ein weiteres Gen, das es in diesem Kontext zu erwähnen gilt, ist das ApoE und die entsprechenden Polymorphismen. Das ApoE kodierende Gen ApoE befindet sich auf Chromosom 19q13.2 und enthält vier Exons und drei Introns (Marais, 2019). Apolipoprotein E (ApoE) ist ein ubiquitäres Lipidtransportprotein, das eine Vielzahl von Lipidspezies bindet, darunter Cholesterin, Phospholipide und Triglyceride in Lipoproteinpartikeln (Mahley et al., 2009). Das ApoE ein Protein mit einer zentralen Rolle im Cholesterol- und Lipid-Transport und -Stoffwechsel (Mahley, 1988).
Das Protein ApoE transportiert Triglyzeride, fettlösliche Vitamine und Cholesterin zuerst in die Lymphbahn und dann ins Blut. Das ApoE-Gen existiert in drei Hauptallelen: ApoE2, ApoE3 und ApoE4. Bei 3 Genvarianten ergeben sich, da je eine Kopie von jedem Elternteil weitergegeben wird, 6 Genotypen (Apo E2/E2, Apo E2/E3, Apo E2/E4, Apo E3/E3, Apo E3/E4 und Apo E4/E4). Der häufigste Genotyp ist E3/E3.
Dass ApoE4-Träger ein erhöhtes Risiko haben, am M. Alzheimer zu erkranken, ist bekannt. Diese verschiedenen ApoE-Allele beeinflussen allerdings auch, wie Cholesterin und andere Lipide im Körper verstoffwechselt werden. Dies spielt für das Auftreten von Herz-Kreislauf-Erkrankungen eine entscheidende Rolle, denn Dyslipidämie ist eine der Ursachen für die koronare Herzkrankheiten (KHK) und ApoE-Genpolymorphismen beeinflussen den Lipidspiegel.
Im Vergleich zu ApoE3 ist ApoE4 beispielsweise mit einem erhöhten Risiko für nicht-neurologische Erkrankungen wie Hypercholesterinämie, Hypertriglyzeridämie und Herz-Kreislauf-Erkrankungen verbunden (Bennet et al., 2007; Carvalho-Wells et al., 2012; Dallongeville et al., 1992). Es besteht ein signifikanter Zusammenhang zwischen dem ApoE4-Allel und einer Hypercholesterinämie (Lozano et al., 2021). Die Auswirkungen von ApoE4 Trägern auf das LDL-Cholesterin (höheres Gesamt- und LDL-Cholesterin und niedrigeres HDL-Cholesterin) werden ausführlich bei Dunk et al. 2023 (Dunk et al., 2023) diskutiert.
Ein erhöhtes LDL-Cholesterin ist ein bekannter Risikofaktor für Arteriosklerose, Herz-Kreislauf-Erkrankungen wie Herzkrankheiten und Schlaganfälle (Mahley, 2016; Mahley & Rall, 2000; Mahley et al., 2009). Es konnte gezeigt werden, dass ApoE4 zu einer vorzeitigen KHK führt (Zhao et al., 2017). Allerdings sind die Aussagen nicht einheitlich. Die Ergebnisse einer Metaanalyse legen nahe, dass verschiedene ApoE-Allele in verschiedenen Ethnien zu unterschiedlichen Effekten führen könnten, so ist das ApoE2-Allel bei Asiaten ein Risikofaktor für eine vorzeitige koronare Herzerkrankung, während es bei Kaukasiern einen Schutzfaktor darstellen könnte (Zhao et al., 2017). ApoE2 bindet jedoch fehlerhaft an den LDL-Rezeptor (ca. 2 % der normalen Aktivität), da es an Position 158 einen Cysteinrest statt eines Argininrests wie ApoE3 und ApoE4 aufweist (Mahley, 2016). Wegen fehlerhafter Bindung an LDL-Rezeptoren kann die Homozygotie von ApoE2 eine Hyperlipoproteinämie Typ III auslösen, jedoch nur, wenn eine andere Erkrankung zu einer Überproduktion von VLDL oder zu weniger LDL-Rezeptoren führen (Mahley et al., 1999; Mahley & Rall, 2000).

Abbildung 4: Schematische Darstellung der ApoE-Proteinstrukur mit Betrachtung der Änderungen der Aminosäuresequenz durch Polymorphismen und Einteilung in ApoE2, ApoE3 und ApoE4 (adaptiert aus Fernández-Calle et al., 2022)
Die Risikovarianten ApoE2 und ApoE4 erhöhen also vermutlich das Risiko für Herzerkrankungen. Während ApoE2 die atherogenen Lipoproteinwerte erhöht (es bindet schlecht an LDL-Rezeptoren), erhöht ApoE4 die LDL-Werte (es bindet bevorzugt an triglyzeridreiche Lipoproteine mit sehr geringer Dichte, was zu einer Herunterregulierung der LDL-Rezeptoren führt (Mahley, 2016)). Für Träger des ApoE4-Allels ist das Management der Cholesterinwerte entscheidend. Im Folgenden sind einige Strategien aufgeführt.
Einfluss der Ernährung auf die Cholesterinwerte von Risikoallel-Patienten
ApoE4-Träger, die sich reich an gesättigten Fettsäuren, Gesamtfett und Cholesterin ernähren, haben die ungünstigsten Lipidprofile. Diese Patientengruppe profitiert am meisten, wenn sie die Aufnahme dieser Stoffe verringern (Eichner et al., 2002; Gylling & Miettinen, 1992; Lopez-Miranda et al., 1994). Von besonderem Interesse ist, dass die Aufnahme von Omega-3-Fettsäuren und körperliche Aktivität den Einfluss von ApoE4 auf das Risiko für Alzheimer-Krankheit und Herz-Kreislauf-Erkrankungen modifizieren könnten (Bos et al., 2019).
Die Genotypisierung für ApoE könnte dabei helfen, einen gezielten Ansatz zur Krankheitsprävention zu entwickeln. So beschäftigten sich diverse Forschungsgruppen mit dem Einfluss des ApoE-Typus auf den Erfolg von Ernährungsumstellungen für die Prävention von Erkrankungen. Die Einhaltung einer Mittelmeerdiät könnte beispielsweise die Symptome im Zusammenhang mit der Alzheimer-Krankheit verringern, wobei sich stärkere Effekte bei Probanden ohne ApoE4-Genotyp zeigen (Martinez-Lapiscina et al., 2014). Das bestätigte sich in einer weiteren Studie, in der verglichen wurde, wie sich gesunde Lifestyle-Faktoren von ApoE4-Trägern gegenüber Nicht-Trägern auf den kognitiven Abbau auswirken (Dhana et al., 2021). Es zeigte sich, dass sie Gruppe der ApoE4-Träger einen stärkeren kognitiven Verfall erlebte, wobei gesunde Lifestyle-Faktoren mit einer Reduktion dieses Verfalls assoziiert waren. Personen mit der entsprechenden genetischen Prädisposition zeigen also einen stärkeren kognitiven Abfall, dieser war in Verbindung mit gesunden Lifestyle-Faktoren jedoch auch bei ApoE4-Trägern reduziert. Das unterstreicht erneut die Bedeutung der Prävention mittels der Kenntnis über individuelle genetische Merkmale.
Es zeigt sich weiterhin, dass Diäten, die reich an gesättigten Fettsäuren sind, das Alzheimer-Risiko bei ApoE4-Trägern im Vergleich zu Nicht-Trägern um das Siebenfache erhöhen könnten (Kivipelto et al., 2008). Eine Anpassung der Ernährung je nach ApoE-Typus scheint also vielversprechend zu sein.
Bewegung und ApoE
Regelmäßige körperliche Aktivität kann helfen, LDL-Cholesterin zu senken und HDL-Cholesterin zu erhöhen (Liu et al., 2024). Auch bei ApoE3 und E2-Trägern führte körperliche Aktivität zu einem geringerem 18-Jahres-Mortalitätsrisiko, als bei sitzenden Personen (Dankner et al., 2020). Abhängig vom ApoE-Genotyp waren die BMI-Veränderungen bei körperlicher Aktivität in der ApoE4-Gruppe jedoch signifikant höher als in der ApoE3-Gruppe. Gesamtcholesterin, Low-Density-Lipoprotein (LDL) und Triglyceride sanken und High-Density-Lipoprotein (HDL) stieg in beiden Gruppen signifikant an (Lee et al., 2018).
Medikamente bei ApoE-Polymorphismen
In einigen Fällen können Medikamente wie Statine verschrieben werden, um die Cholesterinwerte zu regulieren. Die Wirksamkeit und Notwendigkeit dieser Medikamente kann je nach individuellen Gesundheitsfaktoren und genetischem Profil variieren. Statine werden zur Regulierung des Fettstoffwechsels eingesetzt, da sie den Cholesterinspiegel senken und die Häufigkeit akuter kardiovaskulärer und zerebrovaskulärer Nebenwirkungen verringern. Bei Personen im Alter von 65 Jahren oder älter war eine Behandlung mit Statinen mit einem verringerten Risiko einer Alzheimer-Krankheit verbunden, insbesondere bei ApoE4-Trägern (Rajan et al., 2024). Dabei war die Abnahmerate des Gesamtcholesterins und des LDL als auch die Anstiegsrate von HDL bei ApoE4-Trägern nach der Einnahme von Statinen dennoch viel geringer als bei Nicht-ApoE4-Patienten. Der ApoE-Genpolymorphismus ist somit mit Hyperlipidämie assoziiert und hat einen gewissen Einfluss auf die klinische Wirksamkeit von Statinen bei der Behandlung von Hyperlipidämie (Cai et al., 2021).
Nichtalkoholische Fettleber-Erkrankung (Nonalcoholic fatty liver disease -NAFLD)
Zuletzt soll sich zu dieser Thematik kurz mit den Einflüssen genetischer Polymorphismen auf die Entwicklung einer nicht-alkoholische Fettlebererkrankung (NAFLD) befasst werden. Denn die NAFLD ist eine chronische Erkrankung, die mit genetischen und umweltbedingten Faktoren, Fettleibigkeit, Typ-2-Diabetes und Dyslipidämie in Verbindung steht, bei der sich Fett abnormal in der Leber ansammelt. Derzeit wird die Prävalenz der NAFLD in Deutschland auf etwa 12,25 Millionen Fälle geschätzt, wobei sich dadurch auch eine große wirtschaftliche Last in Höhe von etwa 56 Milliarden Euro pro Jahr ergibt (Younossi et al., 2016). Entsprechend hoch ist der Nutzen einer sinnvollen Risikostratifizierung und auf Basis dessen einer geeigneten Prävention.
Verschiedene genetische Polymorphismen scheinen in diesem Zusammenhang eine Rolle zu spielen (PNPLA3, TM6SF2, PEMT und CHDH-Gene) (Husseini, 2024; Liu et al., 2024; Vasconcellos et al., 2023). In der Datenbank SNPedia werden hier vor allem folgende SNPs in Verbindung mit einer NAFLD gebracht: rs738409 PNPLA3-Gen; rs4880 im SOD2-Gen; rs3750861 im KLF6-Gen; rs13412852 im LPIN1- Gen und rs2854116 und/oder rs2854117 im ApoC3-Gen.
Fazit: Prädiktive Genetik als Werkzeug der Prävention
Die prädiktive Genetik, insbesondere in Kombination mit der Nutrigenetik, bietet ein enormes Potenzial zur Prävention und individuellen Risikobewertung von chronischen Erkrankungen wie Adipositas, Stoffwechselstörungen und Hypercholesterinämie. Durch die Identifikation genetischer Marker, wie Single Nucleotide Polymorphisms (SNPs) im FTO- und ApoE-Gen, können personalisierte Behandlungsstrategien entwickelt und präventive Maßnahmen gezielt eingesetzt werden, bevor sich die Erkrankungen manifestieren sowie das Management dieser Erkrankungen potenziell verbessert werden. Denn die Kenntnis über genetische Prädispositionen ermöglicht es, individuelle Ernährungs- und Lebensstilinterventionen zu gestalten und die allgemeine Gesundheit verbessern – auf eine Art und Weise, die der allgemeinen Prävention potenziell überlegen ist.
Obwohl es noch viele wissenschaftliche Fragen zu klären gibt, zeigt die prädiktive Genetik, dass sie ein nützliches Werkzeug der Präventionsmedizin sein kann.
Prädiktive Genetik: Was Gene über Übergewicht, Cholesterin und den metabolischen Zustand aussagen
Die moderne Medizin steht an der Schwelle zu einem Paradigmenwechsel: Weg von der generischen Behandlung hin zu einer individualisierten Herangehensweise, die auf den genetischen Besonderheiten jedes einzelnen Patienten basiert. Die prädikative Genetik, ein Teilbereich der personalisierten Medizin, ermöglicht es, anhand genetischer Marker, wie den sogenannten Single Nucleotide Polymorphisms (SNPs), Vorhersagen über das Risiko für bestimmte Erkrankungen zu treffen sowie Interventionsmaßnahmen aufzudecken, die dieses Risiko minimieren und die allgemeine Gesundheit verbessern können.
Diese Erkenntnisse könnten also genutzt werden, um präzise Therapien und präventive Maßnahmen zu entwickeln, die auf den individuellen genetischen Hintergrund abgestimmt sind. Dies ermöglicht nicht nur eine gezieltere Behandlung, sondern auch die frühzeitige Identifikation von Risikopatienten. Kann der personalisierte Ansatz also regelhaft in den Praxisalltag eingebunden werden, so verspricht das nicht nur potenziell eine Verbesserung des Behandlungserfolgs, sondern auch einen effektiven Ansatz zur Prävention von Risikopatienten – etwas, was viel diskutiert wird, bei der Umsetzung aber leider oft scheitert.
Ein Teilgebiet, welches im Folgenden genauer beleuchtet werden soll, ist die Nutrigenetik. Es soll darauf geblickt werden, wie dieser Teil der prädiktiven Genetik genutzt werden kann, um das Risiko für häufige Krankheitsbilder wie Adipositas und diverse andere Stoffwechselerkrankungen zu evaluieren und personalisierte Behandlungsstrategien zu entwickeln, wobei kein Anspruch auf Vollständigkeit besteht, sondern lediglich exemplarisch auf die große und zunehmende Rolle genetischer Untersuchungen in der Nutrigenetik hingewiesen werden soll. Erfahren Sie, welche genetischen Marker eine Rolle spielen, wie sie in der Praxis angewendet werden können und welche Vorteile dies für Ihre Patienten bietet.
Was ist Nutrigenetik?
Die Nutrigenetik ist ein Teilgebiet der Genetik, welches die Beziehungen zwischen Genen und Ernährung behandelt. Die Nutrigenetik kann im Zusammenhang mit der prädiktiven Genetik auch als Präzisionsvorbeugung oder Präzisionsernährungstherapie verstanden werden, denn die Diversität der genetischen Profile zwischen Individuen spezifischer ethnischer Gruppen beeinflusst Anforderungen an die Ernährung und den Stoffwechsel sowie Auswirkungen auf die Ernährungstherapie (Ferguson et al., 2016). In Zukunft werden Nutrigenetik und Nutrigenomik mit Daten anderer Omics-Technologien wie Epigenomik, Proteomik, Lipidomik, Foodomics, Metabolomik sowie Mikrobiom- und Datentechnologie kombiniert (Singh, 2023).
Es ist allgemein bekannt und durch zahlreiche Veröffentlichungen belegt, dass eine falsche Ernährung zu verschiedenen Erkrankungen beitragen oder diese verursachen kann. Zu diesen Erkrankungen gehören z. B. Adipositas, Diabetes, Herz-Kreislauf-Erkrankungen, Krebs und Entzündungen (Guevara-Ramirez et al., 2022). Im Speziellen kann eine nutrigenetische Testung genbasierte Ernährungsempfehlungen aussprechen und damit dazu beitragen, Krankheiten zu verhindern oder die Gesundheit zu verbessern (Lal et al., 2022). Das Paradigma der Präzisionsernährung basiert auf der Prämisse, dass erhebliche Unterschiede zwischen Menschen hinsichtlich des ernährungsbedingten Krankheitsrisikos und der Reaktion auf diätetische Interventionen bestehen (Mitchelson et al., 2023).
Nutrigenetische Tests betreffen beispielsweise verschiedene Aspekte im Zusammenhang mit Stoffwechselveränderungen, wie hohem Body Mass Index, zentrale Adipositas, Insulinresistenz, aber auch den zwischen Ernährung und Schlaf oder mit der Appetitregulierung und -kontrolle.

Abbildung 1: Schematische Darstellung des komplexen Ablaufs zur Erstellung personalisierter Behandlungspläne nach dem Prinzip der Präzisionsernährung auf Basis des aktuellen Lifestyles sowie unter Beachtung der genetischen Prädispositionen und weiteren Einflussfaktoren (adaptiert aus Mitchelson et al., 2023)
Weitere Einflüsse der Nutrigenetik lassen sich im Bereich der Nahrungsmittelintoleranzen sowie innerhalb des Stoffwechsels von Vitaminen und Mineralstoffen. Diese werden detailliert auf den Seiten … bis … beleuchtet.
Das FTO-Gen, Adipositas und gängige Polymorphismen
Adipositas ist eine chronische Krankheit, die definiert ist, als eine über das Normalmaß hinausgehende Vermehrung des Körperfetts. Berechnungsgrundlage dafür ist der Body Mass Index (BMI), der einen Quotienten aus Gewicht und Köpergröße zum Quadrat (kg/m2) darstellt. Im Vergleich zum Jahr 1999 stieg die Übergewicht- und Adipositas-Prävalenz in den vergangenen Jahren deutlich an. In Deutschland sind 2022 insgesamt 53,5 % der Bevölkerung (46,6% der Frauen und 60,5% der Männer) von Übergewicht (einschließlich Adipositas) betroffen. Bei 19,0% der Erwachsenen liegt eine Adipositas vor (Schienkiewitz et al., 2022). Es besteht also akuter Handlungs- und Präventionsbedarf, denn die Zahl an mit Übergewicht und Adipositas assoziierten Erkrankungen ist groß.

Abbildung 2: Übergewicht- und Adipositas-Prävalenz der Erwachsenen in Deutschland, Verteilung nach Alter und Geschlecht (adaptiert aus Schienkiewitz et al., 2022)
Durch genomweite Assoziationsstudien wurden zahlreiche mit Adipositas in Zusammenhang stehende Genloci identifiziert. Dabei war das Fettmasse- und Adipositas-assoziierte Gen (FTO-Gen), welches auf dem Chromosom 16q12.2 lokalisiert ist (9 Exons und 8 Introns), eines der ersten und am besten beschriebenen Adipositas-assoziierten Gene (Loos, 2012).
Funktionell ist das Produkt des FTO-Gens ein Enzym mit mRNA-Demethylasefunktion (v. a. N6-(Di-)Methyladenosin-Demethylase; m6A-Demethylase). Zahlreiche zelluläre Prozesse werden durch m6A-Modifikation moduliert, darunter alternatives Spleißen, mRNA-Stabilität, Translation, Transport, Abbau und Genregulation, das Ungleichgewicht von m6A wurde mit daher verschiedenen Erkrankungen in Verbindung gebracht, darunter Fettleibigkeit, Diabetes, Herzversagen, Hirnerkrankungen und verschiedene Tumore (Azzam et al., 2022).
Interessanterweise könnte das FTO-Gen so eine gemeinsame genetische Grundlage für die Zunahme von Fettleibigkeit und Krebs bilden (Lan et al., 2020). Adipositas erhöht das Krebsrisiko bei mindestens 13 Krebsarten (Goodwin & Stambolic, 2015) und steht weiterhin in einem engen Zusammenhang mit einem breiten Spektrum teils pathologischer Verhaltensauffälligkeiten, wie z. B. Aufmerksamkeitsdefiziten, affektiven Symptomen und Drogenmissbrauch (Hess & Bruning, 2014) und auch von Herz-Kreislauf-Erkrankungen (Liu et al., 2013; Xu et al., 2023). Eine Betrachtung des FTO-Gens und der relevanten SNPs in diesem Zusammenhang hat also auch aus dieser Perspektive eine potenzielle Relevanz in der Prävention.
FTO-SNP rs9939609 (T/A)
Der klassische BMI-bezogene FTO-SNPs war rs9939609 (T/A). 16 % der Erwachsenen, die das homozygote Risikoallel (AA) trugen, nahmen fast 3 kg an Gewicht zu und das Risiko für eine Fettleibigkeit stieg um das 1,67-Fache (Frayling et al., 2007). Menschen mit FTO-Risiko-Allelen neigen zu einer energiereicheren Ernährung und einem verringerten Sättigungsgefühl und können die Kontrolle über das Essen verlieren (Ahmad et al., 2011; Cecil et al., 2008; Sonestedt et al., 2009; Tanofsky-Kraff et al., 2009). Genomweite Assoziationsstudien (GWAS) haben Varianten innerhalb von Introns von FTO reproduzierbar mit einem erhöhten Risiko für Fettleibigkeit und Typ-2-Diabetes in Verbindung gebracht (Dina et al., 2007; Frayling et al., 2007; Scuteri et al., 2007).
Dieser SNP wird weiterhin mit einem erhöhten BMI oder erhöhter Energieaufnahme (Speakman et al., 2008) bei Europäern, Brasilianer und Chinesen in Verbindung gebracht (da Fonseca et al., 2019; Jiang et al., 2019; Mehrdad et al., 2020). Bei erwachsenen Menschen konnte gezeigt werden, dass diese mit den gefährdeten AT- und AA-Allelen täglich zwischen 500 und 1250 kJ mehr zu sich nahmen als Träger des schützenden TT-Genotyps (Speakman et al., 2008). Der Genotyp FTO rs9939609 wurde außerdem mit einer erhöhten Expression des Hormons Ghrelin in Verbindung gebracht, welches das Verdauungsverhalten reguliert und zu einer erhöhten Aufnahme von kalorienreicheren Lebensmitteln führt (Karra et al., 2013).
Das menschliche FTO-Gen mit den genetischen Varianten rs9939609 und rs9930506, die beide im Intron 1 sind, trägt zudem erheblich zur frühen Entstehung des metabolischen Syndroms bei Kindern und Jugendlichen bei (Song et al., 2023). Die mit Fettleibigkeit verbundene nicht-kodierende Region innerhalb des FTO-Gens (Introns) interagiert direkt mit dem Promotor von IRX3 und IRX5, die ebenfalls mit Fettleibigkeit in Verbindung stehen (Smemo et al., 2014). Mit Fettleibigkeit assoziierte FTO-SNPs im Intron 1 (wie rs9939609, aber auch rs17817449, rs3751812, rs1421085, rs9930506 und rs7202116) weisen insgesamt eine starke Assoziation mit Übergewicht oder Fettleibigkeit auf.

Abbildung 3: Schematische Darstellung des Einflusses verschiedener SNPs im Bereich des Intron 1 des FTO-Gens auf die Expression anderer Gene; diese zusätzliche Regulation ist ein Ansatzpunkt zur Erklärung der Assoziation der FTO-SNPs mit Übergewicht und Krebs (adaptiert aus Lan et al., 2020)
Die Ergebnisse deuten zwar klar auf den Zusammenhang des Risikoallels von rs9939609, das Ausmaß und der Eintritt der Adipositas ist jedoch vermutlich abhängig vom Lebensstil der Individuen. Eine groß angelegte Metaanalyse (218.166 Erwachsene und 19.268 Kinder) zeigte, dass das homozygote FTO-Risikoallel (rs9939609) mit einem um 27 % geringeren Risiko für Fettleibigkeit bei körperlich aktiven Erwachsenen verbunden war, im Vergleich zu jenen, die inaktiv waren und das Risikoallel trugen (Kilpelainen et al., 2011). Diese Ergebnisse wurden kürzlich bestätigt und erneut auf die Notwendigkeit einer erhöhten körperlichen Aktivität bei Personen mit dem Risikophänotyp (rs9939609) hingewiesen (Martinez-Lopez et al., 2024). Epigenetische Einflüsse auf das FTO-Gen werden als neuer Ansatz in der Behandlung der Adipositas abhängig vom Einzelnukleotid-Polymorphismus diskutiert (Popovic et al., 2023).
Nicht nur der klassische Polymorphismus rs9939609 zeigt Assoziationen mit der Entstehung von Übergewicht und Adipositas. Auch andere SNPs, besonders jene, die sich im Intron 1 befinden, zeigen sich als relevant. Daher sollen im Folgenden auch die weiteren SNPs kurz aufgeführt werden.
Weitere FTO-SNPs
Der Polymorphismus rs9930506 ist sowohl bei Europäern und verschiedenen anderen Ethnien (z.B. Asiaten) mit der Gewichtsregulation und einem erhöhten BMI assoziiert (Cauchi et al., 2009; Chang et al., 2008; Dina et al., 2007; Haupt et al., 2008; Scuteri et al., 2007). Auch die SNPs rs1421085, rs8050136 und rs1121980 sind bei Europäern mit einer Adipositas verbunden (Cauchi et al., 2009; Dina et al., 2007; Haupt et al., 2008; Scuteri et al., 2007).
Je nach Abstammung unterscheidet sich der Einfluss eines SNPs auf die Entwicklung von Übergewicht und Adipositas. Der SNP rs17817449 zeigt beispielsweise besonders bei Menschen mit chinesischer Abstammung eine hohe Korrelation mit dem BMI (Wen et al., 2012).
FTO-Gen und weitere Pathologien
Einige Polymophismen des FTO-Gens (rs9939609, rs8050136, rs1477196, rs6499640, rs1121980, rs17817449, rs11075995, rs8047395 und rs7206790) sind mit einem höheren Krebsrisiko verbunden (Hernandez-Caballero & Sierra-Ramirez, 2015).
Der typischste FTO-SNP rs9939609 wurde mit Lungenkrebs, Nierenkrebs, Brustkrebs, Prostatakrebs, Bauchspeicheldrüsenkrebs und Gebärmutterkrebs in Verbindung gebracht (Delahanty et al., 2011; Kaklamani et al., 2011; Lin et al., 2013). Allerdings wurde eine Schutzfunktion des AG-Genotyps (rs9930506) gegen das Bronchialkarzinom postuliert (Hernandez-Caballero et al., 2024).
Jüngste Studien haben zudem gezeigt, dass das FTO-Gen eine entscheidende Rolle bei der Entstehung und dem Fortschreiten von Herz-Kreislauf-Erkrankungen wie Myokardfibrose, Herzinsuffizienz und Arteriosklerose spielt (Xu et al., 2023).
Es bleibt also spannend um die Einflüsse des FTO-Gens, die vermutlich weit über das metabolische Syndrom und Adipositas hinausreichen. Im Kontext der Prävention kann anhand einer Bestimmung eventueller Polymorphismen des FTO-Gens gegebenenfalls eine Optimierung des Lebensstils erfolgen, beispielsweise hinsichtlich der Ernährung und körperlicher Betätigung.
ApoE-Gen: Einfluss von Genpolymorphismen auf den Lipidstoffwechsel
Ein weiteres Gen, das es in diesem Kontext zu erwähnen gilt, ist das ApoE und die entsprechenden Polymorphismen. Das ApoE kodierende Gen ApoE befindet sich auf Chromosom 19q13.2 und enthält vier Exons und drei Introns (Marais, 2019). Apolipoprotein E (ApoE) ist ein ubiquitäres Lipidtransportprotein, das eine Vielzahl von Lipidspezies bindet, darunter Cholesterin, Phospholipide und Triglyceride in Lipoproteinpartikeln (Mahley et al., 2009). Das ApoE ein Protein mit einer zentralen Rolle im Cholesterol- und Lipid-Transport und -Stoffwechsel (Mahley, 1988).
Das Protein ApoE transportiert Triglyzeride, fettlösliche Vitamine und Cholesterin zuerst in die Lymphbahn und dann ins Blut. Das ApoE-Gen existiert in drei Hauptallelen: ApoE2, ApoE3 und ApoE4. Bei 3 Genvarianten ergeben sich, da je eine Kopie von jedem Elternteil weitergegeben wird, 6 Genotypen (Apo E2/E2, Apo E2/E3, Apo E2/E4, Apo E3/E3, Apo E3/E4 und Apo E4/E4). Der häufigste Genotyp ist E3/E3.
Dass ApoE4-Träger ein erhöhtes Risiko haben, am M. Alzheimer zu erkranken, ist bekannt. Diese verschiedenen ApoE-Allele beeinflussen allerdings auch, wie Cholesterin und andere Lipide im Körper verstoffwechselt werden. Dies spielt für das Auftreten von Herz-Kreislauf-Erkrankungen eine entscheidende Rolle, denn Dyslipidämie ist eine der Ursachen für die koronare Herzkrankheiten (KHK) und ApoE-Genpolymorphismen beeinflussen den Lipidspiegel.
Im Vergleich zu ApoE3 ist ApoE4 beispielsweise mit einem erhöhten Risiko für nicht-neurologische Erkrankungen wie Hypercholesterinämie, Hypertriglyzeridämie und Herz-Kreislauf-Erkrankungen verbunden (Bennet et al., 2007; Carvalho-Wells et al., 2012; Dallongeville et al., 1992). Es besteht ein signifikanter Zusammenhang zwischen dem ApoE4-Allel und einer Hypercholesterinämie (Lozano et al., 2021). Die Auswirkungen von ApoE4 Trägern auf das LDL-Cholesterin (höheres Gesamt- und LDL-Cholesterin und niedrigeres HDL-Cholesterin) werden ausführlich bei Dunk et al. 2023 (Dunk et al., 2023) diskutiert.
Ein erhöhtes LDL-Cholesterin ist ein bekannter Risikofaktor für Arteriosklerose, Herz-Kreislauf-Erkrankungen wie Herzkrankheiten und Schlaganfälle (Mahley, 2016; Mahley & Rall, 2000; Mahley et al., 2009). Es konnte gezeigt werden, dass ApoE4 zu einer vorzeitigen KHK führt (Zhao et al., 2017). Allerdings sind die Aussagen nicht einheitlich. Die Ergebnisse einer Metaanalyse legen nahe, dass verschiedene ApoE-Allele in verschiedenen Ethnien zu unterschiedlichen Effekten führen könnten, so ist das ApoE2-Allel bei Asiaten ein Risikofaktor für eine vorzeitige koronare Herzerkrankung, während es bei Kaukasiern einen Schutzfaktor darstellen könnte (Zhao et al., 2017). ApoE2 bindet jedoch fehlerhaft an den LDL-Rezeptor (ca. 2 % der normalen Aktivität), da es an Position 158 einen Cysteinrest statt eines Argininrests wie ApoE3 und ApoE4 aufweist (Mahley, 2016). Wegen fehlerhafter Bindung an LDL-Rezeptoren kann die Homozygotie von ApoE2 eine Hyperlipoproteinämie Typ III auslösen, jedoch nur, wenn eine andere Erkrankung zu einer Überproduktion von VLDL oder zu weniger LDL-Rezeptoren führen (Mahley et al., 1999; Mahley & Rall, 2000).

Abbildung 4: Schematische Darstellung der ApoE-Proteinstrukur mit Betrachtung der Änderungen der Aminosäuresequenz durch Polymorphismen und Einteilung in ApoE2, ApoE3 und ApoE4 (adaptiert aus Fernández-Calle et al., 2022)
Die Risikovarianten ApoE2 und ApoE4 erhöhen also vermutlich das Risiko für Herzerkrankungen. Während ApoE2 die atherogenen Lipoproteinwerte erhöht (es bindet schlecht an LDL-Rezeptoren), erhöht ApoE4 die LDL-Werte (es bindet bevorzugt an triglyzeridreiche Lipoproteine mit sehr geringer Dichte, was zu einer Herunterregulierung der LDL-Rezeptoren führt (Mahley, 2016)). Für Träger des ApoE4-Allels ist das Management der Cholesterinwerte entscheidend. Im Folgenden sind einige Strategien aufgeführt.
Einfluss der Ernährung auf die Cholesterinwerte von Risikoallel-Patienten
ApoE4-Träger, die sich reich an gesättigten Fettsäuren, Gesamtfett und Cholesterin ernähren, haben die ungünstigsten Lipidprofile. Diese Patientengruppe profitiert am meisten, wenn sie die Aufnahme dieser Stoffe verringern (Eichner et al., 2002; Gylling & Miettinen, 1992; Lopez-Miranda et al., 1994). Von besonderem Interesse ist, dass die Aufnahme von Omega-3-Fettsäuren und körperliche Aktivität den Einfluss von ApoE4 auf das Risiko für Alzheimer-Krankheit und Herz-Kreislauf-Erkrankungen modifizieren könnten (Bos et al., 2019).
Die Genotypisierung für ApoE könnte dabei helfen, einen gezielten Ansatz zur Krankheitsprävention zu entwickeln. So beschäftigten sich diverse Forschungsgruppen mit dem Einfluss des ApoE-Typus auf den Erfolg von Ernährungsumstellungen für die Prävention von Erkrankungen. Die Einhaltung einer Mittelmeerdiät könnte beispielsweise die Symptome im Zusammenhang mit der Alzheimer-Krankheit verringern, wobei sich stärkere Effekte bei Probanden ohne ApoE4-Genotyp zeigen (Martinez-Lapiscina et al., 2014). Das bestätigte sich in einer weiteren Studie, in der verglichen wurde, wie sich gesunde Lifestyle-Faktoren von ApoE4-Trägern gegenüber Nicht-Trägern auf den kognitiven Abbau auswirken (Dhana et al., 2021). Es zeigte sich, dass sie Gruppe der ApoE4-Träger einen stärkeren kognitiven Verfall erlebte, wobei gesunde Lifestyle-Faktoren mit einer Reduktion dieses Verfalls assoziiert waren. Personen mit der entsprechenden genetischen Prädisposition zeigen also einen stärkeren kognitiven Abfall, dieser war in Verbindung mit gesunden Lifestyle-Faktoren jedoch auch bei ApoE4-Trägern reduziert. Das unterstreicht erneut die Bedeutung der Prävention mittels der Kenntnis über individuelle genetische Merkmale.
Es zeigt sich weiterhin, dass Diäten, die reich an gesättigten Fettsäuren sind, das Alzheimer-Risiko bei ApoE4-Trägern im Vergleich zu Nicht-Trägern um das Siebenfache erhöhen könnten (Kivipelto et al., 2008). Eine Anpassung der Ernährung je nach ApoE-Typus scheint also vielversprechend zu sein.
Bewegung und ApoE
Regelmäßige körperliche Aktivität kann helfen, LDL-Cholesterin zu senken und HDL-Cholesterin zu erhöhen (Liu et al., 2024). Auch bei ApoE3 und E2-Trägern führte körperliche Aktivität zu einem geringerem 18-Jahres-Mortalitätsrisiko, als bei sitzenden Personen (Dankner et al., 2020). Abhängig vom ApoE-Genotyp waren die BMI-Veränderungen bei körperlicher Aktivität in der ApoE4-Gruppe jedoch signifikant höher als in der ApoE3-Gruppe. Gesamtcholesterin, Low-Density-Lipoprotein (LDL) und Triglyceride sanken und High-Density-Lipoprotein (HDL) stieg in beiden Gruppen signifikant an (Lee et al., 2018).
Medikamente bei ApoE-Polymorphismen
In einigen Fällen können Medikamente wie Statine verschrieben werden, um die Cholesterinwerte zu regulieren. Die Wirksamkeit und Notwendigkeit dieser Medikamente kann je nach individuellen Gesundheitsfaktoren und genetischem Profil variieren. Statine werden zur Regulierung des Fettstoffwechsels eingesetzt, da sie den Cholesterinspiegel senken und die Häufigkeit akuter kardiovaskulärer und zerebrovaskulärer Nebenwirkungen verringern. Bei Personen im Alter von 65 Jahren oder älter war eine Behandlung mit Statinen mit einem verringerten Risiko einer Alzheimer-Krankheit verbunden, insbesondere bei ApoE4-Trägern (Rajan et al., 2024). Dabei war die Abnahmerate des Gesamtcholesterins und des LDL als auch die Anstiegsrate von HDL bei ApoE4-Trägern nach der Einnahme von Statinen dennoch viel geringer als bei Nicht-ApoE4-Patienten. Der ApoE-Genpolymorphismus ist somit mit Hyperlipidämie assoziiert und hat einen gewissen Einfluss auf die klinische Wirksamkeit von Statinen bei der Behandlung von Hyperlipidämie (Cai et al., 2021).
Nichtalkoholische Fettleber-Erkrankung (Nonalcoholic fatty liver disease -NAFLD)
Zuletzt soll sich zu dieser Thematik kurz mit den Einflüssen genetischer Polymorphismen auf die Entwicklung einer nicht-alkoholische Fettlebererkrankung (NAFLD) befasst werden. Denn die NAFLD ist eine chronische Erkrankung, die mit genetischen und umweltbedingten Faktoren, Fettleibigkeit, Typ-2-Diabetes und Dyslipidämie in Verbindung steht, bei der sich Fett abnormal in der Leber ansammelt. Derzeit wird die Prävalenz der NAFLD in Deutschland auf etwa 12,25 Millionen Fälle geschätzt, wobei sich dadurch auch eine große wirtschaftliche Last in Höhe von etwa 56 Milliarden Euro pro Jahr ergibt (Younossi et al., 2016). Entsprechend hoch ist der Nutzen einer sinnvollen Risikostratifizierung und auf Basis dessen einer geeigneten Prävention.
Verschiedene genetische Polymorphismen scheinen in diesem Zusammenhang eine Rolle zu spielen (PNPLA3, TM6SF2, PEMT und CHDH-Gene) (Husseini, 2024; Liu et al., 2024; Vasconcellos et al., 2023). In der Datenbank SNPedia werden hier vor allem folgende SNPs in Verbindung mit einer NAFLD gebracht: rs738409 PNPLA3-Gen; rs4880 im SOD2-Gen; rs3750861 im KLF6-Gen; rs13412852 im LPIN1- Gen und rs2854116 und/oder rs2854117 im ApoC3-Gen.
Fazit: Prädiktive Genetik als Werkzeug der Prävention
Die prädiktive Genetik, insbesondere in Kombination mit der Nutrigenetik, bietet ein enormes Potenzial zur Prävention und individuellen Risikobewertung von chronischen Erkrankungen wie Adipositas, Stoffwechselstörungen und Hypercholesterinämie. Durch die Identifikation genetischer Marker, wie Single Nucleotide Polymorphisms (SNPs) im FTO- und ApoE-Gen, können personalisierte Behandlungsstrategien entwickelt und präventive Maßnahmen gezielt eingesetzt werden, bevor sich die Erkrankungen manifestieren sowie das Management dieser Erkrankungen potenziell verbessert werden. Denn die Kenntnis über genetische Prädispositionen ermöglicht es, individuelle Ernährungs- und Lebensstilinterventionen zu gestalten und die allgemeine Gesundheit verbessern – auf eine Art und Weise, die der allgemeinen Prävention potenziell überlegen ist.
Obwohl es noch viele wissenschaftliche Fragen zu klären gibt, zeigt die prädiktive Genetik, dass sie ein nützliches Werkzeug der Präventionsmedizin sein kann.




Hinterlasse einen Kommentar
Du musst angemeldet sein, um einen Kommentar schreiben zu können.